Die Entwicklungen im Bereich der Diabetestherapie sind enorm. Im Folgenden soll der Fokus auf Innovationen bei der Therapie des Diabetes mellitus Typ 1 (T1D) liegen. Dabei kommt es zu einer autoimmun vermittelten Zerstörung der insulinproduzierenden Betazellen des Pankreas mit der Folge eines kompletten Insulinmangels und der Notwendigkeit zur lebenslangen Substitution von Insulin.
Im breiten Fokus steht die rasante Entwicklung der technologischen Hilfsmittel und dies bietet den Menschen mit Diabetes mellitus Typ 1 große Chancen in Bezug auf eine Verbesserung der Lebensqualität und der Therapieergebnisse. Besonders gespannt blicken wir aber auf die ersten klinischen Ergebnisse zur Transplantation von stammzellbasierten Inselzellen bei Menschen mit Diabetes mellitus Typ 1. Dies stellt einen wichtigen Meilenstein im Bereich der biologischen Betazellersatztherapie dar. Der aktuelle Stand, die Perspektiven, aber auch die bestehenden Limitationen und offenen Fragen dieser Forschungsrichtung sollen hier beleuchtet werden.
Historie und Status quo
Nach der ersten Transplantation einer Bauchspeicheldrüse in den 1960er-Jahren [1] und den ersten Berichten über Inselzelltransplantation in den 1970er-Jahren [2, 3] wird von zwei Forschergruppen nun über die Transplantation von pluripotenten stammzellbasierten Inselzellen zur Diabetestherapie berichtet [4, 5]. Dies ist insbesondere, aber nicht nur für Menschen mit einem insulindefizienten Diabetes mellitus Typ 1 eine bedeutsame Entwicklung.
Weltweit leben derzeit 463 Millionen Menschen mit Diabetes und der internationale Diabetesverband (International Diabetes Federation, IDF) prognostiziert bis zum Jahr 2045 eine Zunahme der Prävalenz um 51 % auf 700 Millionen Menschen mit Diabetes (https://diabetesatlas.org). Etwa 10 % dieser Menschen haben einen Diabetes mellitus Typ 1, eine Autoimmunerkrankung, die durch Zerstörung der insulinproduzierenden Betazellen der Bauchspeicheldrüse zu einem Insulinmangel führt. Die dauerhafte Gabe von Insulin von außen ist bei dieser Gruppe lebensnotwendig. International arbeiten unzählige Gruppen von Forschenden daran, breit verfügbare, sichere und bezahlbare Therapien zu entwickeln. Die enorme Heterogenität der Erkrankung erfordert dabei individuelle Therapieansätze und kluge Konzepte des Behandlungsmanagements.
Die Betazellersatztherapie stellt die ultimative Therapieoption für Menschen mit einem Insulinmangeldiabetes dar. Bis heute bestehen allerdings Einschränkungen, die einer breiteren Anwendung entgegenstehen und die Indikation bislang auf wenige erwachsene Patienten mit T1D mit Spätkomplikationen oder ausgeprägter metabolischer Instabilität beschränken.
Klinisch verfügbare Therapiekonzepte
Für Patientinnen und Patienten mit einem Insulinmangeldiabetes (Diabetes mellitus Typ 1, Spätstadium des Diabetes mellitus Typ 2, Diabetes mellitus Typ 4) ist die exogene Insulintherapie eine optimale, sichere und effektive Behandlungsform. Das Konzept der multiplen täglichen Insulininjektion (Multiple Daily Injection [MDI]-Therapie) oder der kontinuierlichen subkutanen Insulininfusion über eine Insulinpumpe (Continuous Subcutaneous Insulin Infusion, CSII) sind die Standardtherapien zum Erreichen einer akzeptablen Stoffwechselkontrolle und eines Minimierens von Spätfolgen [6]. Die enormen Entwicklungen der letzten Jahre im Bereich der Diabetestechnologie (kontinuierliche Glukosemessung, Insulinpumpen, sensorunterstützte Insulinpumpensysteme, Hybrid-Closed-Loop-Systeme) haben Eingang in die Routinebehandlung gefunden und zeigen insbesondere bei Menschen mit ausgeprägter metabolischer Instabilität einen signifikanten Vorteil und helfen vor allem, schwere Unterzuckerungen zu verhindern und die Lebensqualität entscheidend zu verbessern. Dennoch stellt die Erkrankung eine erhebliche "24/7"-Herausforderung dar und bedeutet unter anderem durch die Angst vor Hypoglykämien und diabetesassoziierten Komplikationen eine hohe psychosoziale Belastung. Die Insulintherapie ist damit weit entfernt davon, als "Heilung" bezeichnet werden zu können. Eine Betazellersatztherapie durch zellbasierte oder (bio-)technologische Ansätze oder eine Kombination aus beiden hat hingegen das Potenzial, eine endogene Insulinsekretion und regulatorische Prozesse wiederherzustellen und damit die Erkrankung "funktionell zu heilen".
Die derzeit einzig klinisch verfügbaren Methoden zur Betazellersatztherapie sind die Pankreas- und die Inseltransplantation. Beide Therapieformen führen bei Menschen mit Diabetes mellitus Typ 1 zu einem effektiven Verhindern von Hypoglykämien, können eine normale Stoffwechselkontrolle wiederherstellen und diabetesassoziierte Komplikationen verhindern oder zumindest stabilisieren. Beide Transplantationsformen sind allerdings durch die mangelnde Verfügbarkeit von menschlichen Spenderorganen erheblich eingeschränkt. Eine weitere entscheidende Limitation dieser Therapieformen bedeutet die Notwendigkeit dauerhafter systemischer Immunsuppression, um Abstoßungsreaktionen zu verhindern. Diese Medikamente können schwere Nebenwirkungen wie Infektionen und erhöhte Krebsgefahr haben. Vor einer Transplantation muss daher immer eine sorgsame Nutzen-Risiko-Abwägung erfolgen. Insofern bleiben diese Behandlungsformen wenigen Patienten mit schweren diabetesassoziierten Komplikationen (z. B. simultane Pankreas-Nieren-Transplantation bei Patientinnen und Patienten mit diabetischer Nephropathie) und/oder kritischen Problemen mit häufigen schweren Hypoglykämien bzw. Hypoglykämiewahrnehmungsstörungen vorbehalten.
Perspektiven der Transplantation
Im Jahr 2006 veröffentlichten Wissenschaftler des Unternehmens Novocell (heute ViaCyte) ein 5-stufiges Protokoll zum Differenzieren von humanen embryonalen Stammzellen (hESCs) in unreife pankreatische inselartige Zellen [7]. Diesem mehrschrittigen Protokoll lag eine Manipulation der entscheidenden Signalwege zugrunde, die von der Embryonalentwicklung des Pankreas abgeleitet wurden. Folgestudien konnten zeigen, dass so generierte pankreatische endodermale Zellen nach Transplantation in Tiermodellen weiterreifen und sich zu voll funktionalen Betazellen entwickeln können [8]. Basierend auf diesen bahnbrechenden Ergebnissen wurden erste klinische Studien mit so generierten Zellen initiiert. In einer frühen Studie wurden die Zellen in ein "geschlossenes Makroverkapselungssystem" eingebracht, das immunoprotektive Eigenschaften besaß, und subkutan in Patienten mit T1D transplantiert wurde (clinicaltrials.gov NCT02239354). Bis heute wurden allerdings keine Daten dieser Studie in einer von Experten begutachteten Fachzeitschrift publiziert.
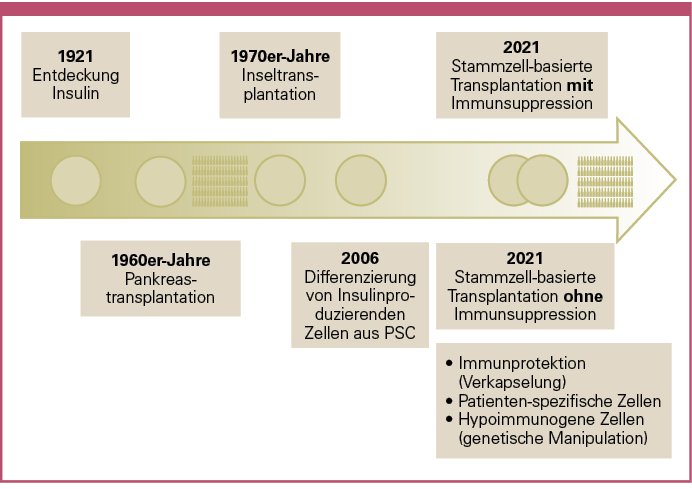 Abb. 1: Bestehende Optionen der biologischen Betazellersatztherapie und mögliche zukünftige Strategien.
Abb. 1: Bestehende Optionen der biologischen Betazellersatztherapie und mögliche zukünftige Strategien.
Zwei aktuelle Veröffentlichungen berichten nun über eine Phase-I/II-Studie, bei der pankreatische endodermale Zellen in einem "offenen" Verkapselungssystem, also ohne immunabschirmende Eigenschaften, transplantiert wurden (clinicaltrials.gov NCT03163511). Es handelt sich dabei um eine multizentrische Studie mit Untersuchung von Sicherheit, Verträglichkeit und Wirksamkeit bei 26 Patientinnen und Patienten mit T1D. Alle Studienteilnehmenden wurden mit immunsuppressiven Medikamenten behandelt, vergleichbar mit den Protokollen, die bei einer klassischen allogenen Inseltransplantation eingesetzt werden. In der entsprechenden Veröffentlichung präsentieren die Autoren überzeugende Hinweise auf eine Insulinsekretion der Zellen nach Implantation [4]. Sie konnten eine kohlenhydratinduzierte Sekretion von C-Peptid nachweisen und damit das Überleben und die Reifung der transplantierten Zellen zu funktionell aktiven Betazellen untermauern. Allerdings waren die gemessenen C-Peptid-Konzentrationen sehr niedrig und sehr variabel. Ein klinisch relevanter Effekt auf die Glykämiekontrolle oder den exogenen Insulinbedarf konnte nicht nachgewiesen werden. Allerdings ist gerade bei dieser Patientengruppe wohlbekannt, dass auch geringe C-Peptid-Konzentrationen mit relevant reduzierten Hypoglykämien und einer verbesserten Glykämiekontrolle assoziiert sind [9]. Weitere Studien sind sicher erforderlich, um die notwendige Dosis von pankreatischen endodermalen Zellen zu finden, die einen relevanten klinischen Effekt für die Patientinnen und Patienten bedeutet. Neben der annehmbar zu geringen Zelldosis in dieser ersten klinischen Studie spielen sicher weitere Faktoren eine wichtige Rolle für die unzureichende funktionelle Potenz. Hierzu gehören Limitationen durch das Verkapselungssystem (Fremdkörperreaktionen, Hypoxie, unzureichende Vaskularisierung, fibröse Ablagerungen usw.), zelltoxische Effekte der Immunsuppression und immunologische Prozesse wie chronische Abstoßungsreaktionen und das nachgewiesene Missverhältnis von Alpha- und Betazellen in den Transplantaten zugunsten von Alphazellen im Vergleich mit nativen humanen Pankreasinseln. In Bezug auf die Sicherheit des Therapieverfahrens wurden die meisten (schweren) unerwünschten Ereignisse mit den verwendeten Immunsuppressiva in Verbindung gebracht. Diese Probleme sind aus der Pankreas- und der Inseltransplantation bekannt und daher nicht überraschend. Es unterstreicht aber erneut, dass die Notwendigkeit einer dauerhaften Immunsuppression eine entscheidende Limitation darstellt und einer breiteren Anwendung einer biologischen Ersatztherapie entgegensteht. Das "offene" Design der verwendeten Kapsel erlaubt theoretisch außerdem ein Entkommen von möglicherweise maligne transformierten Zellen. In dieser Studie wurden allerdings nach Explantation keine Tumorformationen nachgewiesen und auch die Proliferationsrate der Zellen war vergleichsweise gering.
Zusammenfassend kann man konstatieren: Auch wenn in dieser Studie kein klinisch relevanter Effekt erzielt werden konnte, stellt sie dennoch einen Meilenstein für das gesamte Forschungsfeld der Betazellersatztherapie dar. Es ist einer der ersten Berichte über ein funktionelles Ein-Jahres-Transplantatüberleben. Von der Veröffentlichung der Differenzierungsprotokolle und genauen Analyse der Zellprodukte können Entwicklungen für sichere zelltherapeutische Ansätze auch in anderen Bereichen wie der Kardiologie und der neurodegenerativen Erkrankungen profitieren. Es bleiben viele offene Fragen. Zu welchem Differenzierungszeitpunkt sollten die Zellen transplantiert werden und wohin? Es gibt alternative Protokolle, die eine weitergehende Differenzierung in Richtung Betazellen propagieren [10]. Hierzu läuft aktuell ebenfalls eine klinische Studie, wobei die Zellen unverkapselt in das Pfortadersystem der Leber vergleichbar der allogenen klassischen Inseltransplantation infundiert werden (clinicaltrials.gov NCT04786262). Erste sehr vielversprechende Ergebnisse dieser Studie wurden auf dem Jahreskongress der amerikanischen Diabetes-Gesellschaft (American Diabetes Association, ADA) vorgetragen. Mittlerweile wurde die zunächst in den USA und Kanada gestartete Studie VX-880 des Unternehmens Vertex Pharmaceuticals Inc. auf Zentren in Europa ausgeweitet. Größere Patientenzahlen werden dazu beitragen, die dennoch vielen offenen und wichtigen Fragen zu beantworten und neue Impulse für die Forschung zu generieren. Kann mit von Stammzellen abgeleiteten insulinproduzierenden Zellen eine ausreichende Glykämiekontrolle und auch Langzeitwirkung erzielt werden? Was ist das Sicherheitsprofil derartiger Therapien? Wie kann eine allogene Abstoßung und eine Reaktivierung der Autoimmunität ohne den Einsatz potenter Immunsuppressiva verhindert werden?
Zusammenfassung
Der Weg bis zu einer breit verfügbaren und wirksamen biologischen Betazellersatztherapie mit alternativen Zellquellen wie stammzellabgeleiteten Betazellen ist wohl noch weit und Rückschläge sind zu erwarten. Bis dahin bleiben die heute verfügbaren Methoden der Pankreas- und der Inseltransplantation eine wichtige Therapieoption für wenige Patientinnen und Patienten. Aber ein entscheidender Schritt ist getan. Er wird viele Forschende inspirieren und vielen Menschen, die mit T1D leben, Hoffnung auf die Möglichkeit einer funktionellen Heilung ihrer Krankheit geben.
- Die Betazellersatztherapie stellt die ultimative Therapieoption für Patienten mit einem Insulinmangeldiabetes dar.
- Die derzeit einzig klinisch verfügbaren Methoden zur Betazellersatztherapie sind die Pankreas- und die Inseltransplantation, allerdings erheblich eingeschränkt durch die mangelnde Verfügbarkeit von menschlichen Spenderorganen.
- Humane embryonale Stammzellen, die in einem 5-stufigen Protokoll in unreife pankreatische inselartige Zellen differenziert wurden, können in Tiermodellen weiter reifen und sich zu voll funktionalen Betazellen entwickeln.
- So generierte Zellen wurden in Studien in ein "geschlossenes Makroverkapselungssystem" mit immunoprotektiven Eigenschaften und in späteren Studien in ein "offenes" Verkapselungssystem ohne immunabschirmende Eigenschaften eingebracht und transplantiert. In der Veröffentlichung zum offenen System präsentieren die Autoren überzeugende Hinweise auf eine Insulinsekretion der Zellen nach Implantation.
|
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2024; 33 (5) Seite 259-261