Zusammenfassung
Die Symptome einer SARS-CoV-2-Infektion reichen von leichten Grippesymptomen bis hin zu einer schweren COVID-19-Pneumonie. Diabetes mellitus ist neben höherem Alter, Bluthochdruck und anderen chronischen Erkrankungen ein Hauptrisikofaktor für einen schweren Verlauf. Jüngste Studien zeigten, dass die Mundhöhlenschleimhaut die Haupteintrittspforte für das SARS-CoV-2 ist. Das Immunsystem von Menschen mit Diabetes ist ohnehin bereits im Allgemeinen geschwächt. Diabetes führt zu einer chronisch-systemischen Entzündung, die sich regelmäßig auch als Parodontitis in der Mundhöhle manifestiert. Des Weiteren führt eine schlechte Blutzuckereinstellung mit häufigen Hyperglykämien zu einer zusätzlichen Schwächung der mukosalen Immunbarriere. Diese Erkenntnisse liefern plausible Erklärungen für die häufigeren schweren Verläufe von Virusinfektionen der Atemwege bei Diabetespatienten. Die im Speichel oder in der Gingival-krevikular-Flüssigkeit gemessene aktivierte aMMP-8 ist ein etablierter Biomarker zur Messung des Grads der oralen Entzündung. Zum Screening sind aMMP-8-Tests-Schnelltests verfügbar. Wir empfehlen daher, dass die derzeitigen Empfehlungen zur Prävention schweren COVID-19-Erkrankungen um die regelmäßige Untersuchung der Mundgesundheit (inkl. aMMP-8 Messung) sowie um die vorbeugende tägliche Desinfektion von Mund und Rachen erweitert werden sollten. SchlüsselwörterParodontitis, Diabetes mellitus, SARS-CoV-2-Infektion
The Oral-Systemic Link - An overview of the strong correlation between diabetes mellitus, periodontitis and COVID-19 outcome
Summary
Symptoms of SARS-CoV-2 infection range from mild flu symptoms to severe COVID-19 pneumonia. Diabetes mellitus is a major risk factor for a severe course, along with older age, high blood pressure and other chronic diseases. Recent studies have shown that the oral cavity mucosa is the main entry point for the SARS-CoV-2 virus. The immune system of people with diabetes is already generally weakened. Diabetes leads to chronic systemic inflammation, which also regularly manifests as periodontitis in the oral cavity. Furthermore, a poor attitude with frequent hyperglycaemia leads to an additional weakening of the mucosal immune barrier. These findings provide plausible explanations for the more frequent severe courses of viral infections of the respiratory tract in diabetes patients. Activated matrix metalloproteinase-8 (aMMP-8) measured in saliva or gingivo-crevicular fluid is an established biomarker for measuring the degree of oral inflammation. Rapid aMMP-8 tests are available for screening. We suggest that current recommendations for prevention of SARS-CoV-2-associated severe COVID-19 disease should be expanded to include regular oral health screening (including aMMP-8 measurement) and regular daily disinfection of the mouth and throat. Keywords
periodontitis, diabetes mellitus, SARS-CoV-2 infection
Einleitung
Diabetes mellitus ist eine der häufigsten Krankheiten weltweit und betrifft etwa 10 − 12 % der Weltbevölkerung [Lovic 2020]. Sie stellt für alle Länder und Gesellschaften eine große wirtschaftliche Belastung dar [Bommer 2017]. Als sich die SARS-CoV-2-Pandemie weltweit ausbreitete, wurde bei infizierten Menschen mit Diabetes ein doppelt so hohes Risiko für eine schwere COVID-19-Pneumonie und eine mehr als doppelt so hohe Sterblichkeit festgestellt [Kumar 2020, Miller 2020, Pfützner 2020, Li 2023]. Ein ähnlich erhöhtes Risiko für schwere Verläufe wurde bereits zuvor bei anderen Virusinfektionen der Atemwege beobachtet [Li 2019]. Gleichzeitig ist bekannt, dass Menschen mit Diabetes ein höheres Risiko für Parodontitis haben und dass Parodontitis wesentlich zur Entwicklung einer schweren COVID-19-Erkrankung beiträgt [Mealey 2007]. Dieser Artikel soll diese schädliche Dreifachbeziehung beleuchten und Möglichkeiten für Präventionsmaßnahmen aufzeigen.
ACE2: Angiotensin-konvertierendes Enzym II
HIV: Humanes Immundefizienz-Virus
IDF: International Federation of Diabetes
Die oral-systemische Verbindung (Oral-Systemic Link)
Diabetes mellitus gilt als einer der Hauptrisikofaktoren für Parodontitis, da die Anfälligkeit für Parodontitis bei Menschen mit Diabetes um etwa das Dreifache erhöht ist [Mealey 2007, Preshaw 2012]. Sekundäre Komplikationen des Diabetes wie Makroalbuminurie, Nierenerkrankung im Endstadium und die kardiorenale Mortalität (diabetische Nephropathie in Kombination mit ischämischer Herzerkrankung) sind bei Diabetespatienten mit schwerer Parodontitis im Vergleich zu Diabetespatienten ohne Parodontitis um das Zweifache bzw. Dreifache erhöht.
Eine unbehandelte Parodontitis beeinträchtigt die Diabeteseinstellung [Tsai 2002], während die effiziente Behandlung der Parodontitis häufig mit einer klinisch relevanten Verbesserung des HbA1c-Wertes verbunden ist [Teeuw 2010]. Daher ist es notwendig, bereits in den frühen Stadien des Diabetes mellitus auf mögliche orale Komplikationen zu achten. Die IDF (International Federation of Diabetes) [Skamagas 2008] empfiehlt, eine jährliche Untersuchung der Mundhöhle auf Zahnfleischerkrankungen, einschließlich Blutungen beim Zähneputzen, oder die Inspektion auf Schwellungen in die regelmäßigen Routineuntersuchungen bei Diabetes aufzunehmen.
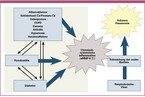
Bei schlechter Blutzuckereinstellung führt eine Hyperglykämie zu einer Schädigung des Bindegewebes in der Mundhöhle mit einer verminderten Synthese von Zahnfleischfibroblasten bis hin zum Verlust von parodontalen Fasern und stützendem Alveolarknochen [Janket 2008]. Eine Hyperglykämie beeinträchtigt außerdem die phagozytische Aktivität mono- und polymorphkerniger Zellen, was zur Entwicklung einer aggressiven pathogenen subgingivalen Flora führt. Daher kann eine parodontale Infektion eine systemische Entzündung auslösen, die ihrerseits eine chronische Insulinresistenz induziert oder verstärkt. Es entsteht ein Teufelskreis aus Hyperglykämie, Parodontitis und Bindegewebsabbau, oraler und systemischer Entzündung und Insulinresistenz, der ohne wirksame gleichzeitige Interventionen gegen alle Erkrankungen kaum zu kontrollieren ist [Janket 2008]. Es gibt also stichhaltige Beweise für das Vorhandensein einer wechselseitigen Beziehung, d. h. eines oral-systemischen Zusammenhangs, zwischen Diabetes und Parodontitis, wobei Diabetes das Risiko für Parodontitis erhöht und die parodontale Entzündung die Blutzuckerkontrolle negativ beeinflusst [Preshaw 2012].
Parodontitis und Atemwegserkrankungen
Eine Lungenentzündung kann generell durch bakterielle, virale, fungale oder parasitäre Infektionen verursacht werden. Normalerweise sind die oberen Atemwege durch den Hustenreflex, die ziliare Bewegung der Schleimhautzellen und angeborene Immunmediatoren vor Mikroorganismen geschützt [Levison 1994]. Eine Beeinträchtigung dieser Abwehrkräfte durch langjähriges Rauchen, Diabetes, chronisch obstruktive Lungenerkrankung oder Immunsuppression, Intubation oder längere postoperative Krankenhausaufenthalte kann jedoch zu einer nosokomialen Pneumonie führen [Sinclair 1994, Toews 1986].
Querschnittstudien haben gezeigt, dass bei zahnlosen Patienten eine schlechte Mundhygiene und die Nichteinhaltung von Zahnarztterminen das Risiko einer Lungenentzündung erhöhen, was darauf hindeutet, dass orale Pathologien eine potenzielle Verbindung zwischen oralen und pulmonalen Erkrankungen darstellen können [Terpenning 1993]. Bei hospitalisierten Personen mit Lungenentzündung wurden die Atemwegserreger Klebsiella pneumoniae, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Haemophilus influenzae und Haemophilus parainfluenzae nachgewiesen [Scannapieco 19952, Scannapieco 2006, Russell 1999], während parodontale Erreger, z.B. Poryphyromonas gingivalis, Fusobacterium nucleatum, Prevotella oralis, Campylobacter gracilis, Fusobacterium necrophorum und Aggregatibacter actinomycetemcomitans, in Lungenaspiraten von Personen mit Pneumonien nachgewiesen wurden [Lorenz 1994, Zijlstra 1992, Yuan 1992, Shinzato 1995].
Zahnfleischerkrankungen (Parodontitis) führen selbst bei leichten bis mittelschweren Formen zu einer Ulzeration des Zahnfleischepithels. Es kann angenommen werden, dass diese freiliegende, ulzerierte Oberfläche das Risiko einer Invasion von Erregern wie SARS-CoV-2 in gleicher Weise erhöht, wie dies bereits für die Übertragung des Humanen Immundefizienz-Virus (HIV) nachgewiesen wurde [Wood 2013, Embree 2000].
In einer kürzlich veröffentlichten Langzeitstudie wurde der Zusammenhang zwischen der Mundgesundheit und dem Auftreten von Lungenentzündungen bei 98 800 Personen in Taiwan über einen Zeitraum von 12 Jahren untersucht. Die Autoren kamen zu dem Schluss, dass Patienten, die eine Parodontalbehandlung erhielten, ein um durchschnittlich 31 % verringertes Risiko für eine Pneumonie hatten. Die Personen, die eine noch intensivere Parodontalbehandlung erhielten, wiesen im Vergleich zur Kontrollgruppe sogar ein um 66 % verringertes Pneumonierisiko auf. Patienten mit Diabetes hatten in dieser Studie bereits unabhängig von der Mundgesundheit im Vergleich zur Kontrollgruppe ein um 78 % erhöhtes Risiko, eine Lungenentzündung zu entwickeln. Diese Studie zeigt demnach den Wert der Mundpflege für die Primärprävention von Pneumonien und insbesondere bei Menschen mit Diabetes [Yang 2020].
In einer systematischen Übersichtsarbeit aus dem Jahr 2017 erwies sich eine bestehende Zahn- und/oder Parodontalerkrankung als signifikanter Risikofaktor für eine ambulant erworbene Lungenentzündung (Odds-Ratio: 2.78) [Almirall 2017]. Außerdem ist bekannt, dass bei beatmeten Patienten eine bakterielle Besiedlung von Zahnbelägen mit respiratorischen Problembakterien wie Staphylococcus aureus oder Pseudomonas aeroginosa nachgewiesen werden kann [Sands 2017, El-Sohl 2004]. Regelmäßige Mundpflege reduzierte bei Krankenhauspatienten und Bewohnern von Pflegeheimen das absolute Pneumonierisiko um 7 – 12 % im Vergleich zum Verzicht auf diese Präventivmaßnahme [Sjörgren 2008]. Bei Beatmungspatienten führt die regelmäßige Mundpflege mit Chlorhexidin zu einer signifikanten Verringerung der beatmungsassoziierten Pneumonie um 18-24 % (Metanalyse von 28 randomisierten kontrollierten Studien) [Hua 2016, Scannapieco 2012, Yoneyama 1996].
Forscher haben den Rezeptor für das Angiotensin-konvertierende Enzym II (ACE2) als den wahrscheinlichen SARS-CoV-2-Rezeptor identifiziert [Zhou 2020]. Jüngste Erkenntnisse deuten darauf hin, dass ACE2 in der Mundhöhle in hohem Maße exprimiert wird. ACE2-Rezeptoren kommen in der Mundhöhle sogar häufiger vor als in der Lunge, die lange Zeit als primärer Infektionsweg für SARS-CoV-2 angesehen wurde [Xu 2020, Wu 2020]. Darüber hinaus werden bei schweren COVID-19-Erkrankungen nachweisbare Viruskonzentrationen im Speichel gefunden, so dass davon ausgegangen werden kann, dass auch in der Mundschleimhaut und den Zahnfleischtaschen eine Viruslast vorhanden ist [To 2020a, Chen 2020, To 2020b]. Diese Ergebnisse deuten darauf hin, dass der erste Eintritt des Virus in den Körper möglicherweise tatsächlich eher über die Mundschleimhaut erfolgt, von wo aus es sich dann auf den Rest des Körpers ausbreitet, wie dies auch für andere Viren beschrieben wurde [Santosh 2020, Ortiz 2018]. Ein von COVID-19-Patienten häufig berichtetes Symptom, der vorübergehende Verlust des Geschmacksempfindens, kann als weiterer Beleg dafür gewertet werden, dass sich das SARS-CoV-2-Virus speziell auf den Mund und seine Schleimhäute als Eintrittspforte konzentriert [Chen 2020, Giacomelli 2020]. Es könnte daher möglicherweise die Sensitivität der Polymerase-Kettenreaktionstests (PCR-Tests) erhöhen, wenn die Rachenhöhle und der Sulcus bzw. die speichelgefüllte Mundfalte in den Abstrich einbezogen würden.
Die orale Immunbarriere
Orale Krankheitserreger können Atemwegserkrankungen verursachen, wenn (i) orale Bakterien oder Atemwegserreger aus oralen Reservoirs in die unteren Atemwege aspiriert werden, (ii) Speichelenzyme, die bei chronischer Parodontalerkrankung oder beim Rauchen freigesetzt werden, die Mundschleimhaut verändern und zu einer verstärkten Adhäsion von Atemwegserregern führen und/oder (iii) zirkulierende proinflammatorische Zytokine, die als Folge einer parodontalen Entzündung freigesetzt werden, die Mundschleimhaut verändern und die Schutzbarriere schwächen [Paju 2007, Li 2007].
Speichelproteine (Mucine und Immunglobuline) spielen eine wichtige Rolle in der natürlichen oralen Immunität, um eine bakterielle Besiedlung der Mundhöhle zu verhindern. Dies gilt insbesondere für Erreger der Atemwege, die häufig im Mund vorkommen, wie Staphylococcus aureus und Pseudomonas aeruginosa. Normalerweise binden Speichelschleimstoffe an Atemwegserreger, um sie zu entfernen, wenn sie in planktonischer Form herumschwimmen. Wenn Staphylococcus aureus jedoch aufgrund mangelnder Mundhygiene einen Biofilm bildet, können die Speichelproteine auch nicht mehr binden, was die bakterielle Besiedlung verstärkt [Heo 2013]. Speichelschleimstoffe und Amylase werden bei Parodontitis vermehrt produziert, da der Körper auf die Krankheit reagiert und versucht, die Bakterien loszuwerden [Heo 2013, Biesbrock 1991].
Es gibt mehrere Hypothesen darüber, wie Speichelenzyme die Besiedlung von Atemwegspathogenen in der Mundhöhle bei Menschen mit und ohne Diabetes fördern [Sanchez 2011, Gomez-Filho 2010, Chan 2012, Gaeckle 2020]:
- Speichelenzyme, die mit Parodontalerkrankungen in Verbindung gebracht werden, können die Schleimhautoberflächen entlang der Atemwege verändern und so die Besiedlung durch Krankheitserreger erleichtern. Zu den möglichen Mechanismen der Veränderung der Schleimhautoberfläche, die zu einer verstärkten bakteriellen Adhäsion führen, gehören (a) die Veränderung des Schleimhautepithels aufgrund hoher Konzentrationen proteolytischer Parodontalbakterien und ihrer spezifischen Enzyme wie Mannosidase, Fucosidase, Hexosaminidase und Sialidase; (b) Verlust von Oberflächenfibronektin, dem Protein, das die Schleimhaut bedeckt, was zur Demaskierung von Oberflächenrezeptoren führt; (c) Entfernung von Oberflächenfibronektin durch hydrolytische Enzyme; und (d) Freisetzung von Zytokinen.
- Hydrolytische Enzyme, die aus Parodontalerkrankungen resultieren, können Speichelfilme zerstören, was die Entfernung von Bakterien erschwert und die Möglichkeit fördert, dass diese Erreger in die Lunge aspiriert werden.
- Entzündungsmediatoren und periphere mononukleäre Zellen, die im Speichel vorhanden sind, können das Epithel der Atemwege verändern und die Besiedlung durch Erreger der Atemwege fördern [Sanchez 2011, Gomez-Filho 2010, Chan 2012, Gaeckle 2020].
Der pathophysiologische Zusammenhang zwischen Mundgesundheit und Lungenerkrankung ist in Abbildung 1 schematisch dargestellt.
Erste epidemiologische Hinweise
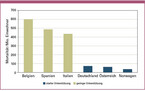
Patienten mit einer vorbestehenden Zahnfleischerkrankung, die häufig mit einer oralen Entzündung und einer damit verbundenen Verminderung der Schutzfunktion der Schleimhaut einhergeht, haben also zusätzlich zu den anderen zu erwartenden systemischen Komplikationen wahrscheinlich ein erhöhtes Risiko für eine COVID-19-Infektion mit schwerem Verlauf. Aktuelle bevölkerungsbezogene Analysen von schweren COVID-19-Verläufen in China [Sun 2020] zeigen hinsichtlich der Altersverteilung deutliche Parallelen zur steigenden Prävalenz von Parodontitis in vergleichbaren Studien, z. B. in den USA [Thornton 2013]. Solche Hochrisikopatienten mit geschädigter Mundschleimhaut sind sich ihres erhöhten Risikos meist nicht bewusst, da die oralen Symptome der chronischen Entzündung oft subklinisch sind. Ein weiterer Hinweis findet sich in den COVID-19-Mortalitätsstatistiken zu Beginn der Pandemie. Europäische Länder ohne regelmäßige und staatlich geförderte Mundhygienesprechstunden und -behandlungen (wie Belgien, Italien und Spanien) wiesen in den Anfangsphasen der Pandemie deutlich höhere Sterberaten auf als Länder mit besser etablierten Mundhygieneprogrammen, aber ansonsten vergleichbarer Infrastruktur und vergleichbarem Lebensstandard (wie Deutschland, Österreich oder Norwegen, Abb. 2) [Mealey 2007].
Der multimorbide Patient mit Parodontitis als Begleiterkrankung hat auch ohne andere zugrunde liegende Atemwegserkrankungen (z. B. COPD) ein erschreckend hohes Pneumonierisiko. Dies ist auf die große Oberfläche der ulzerierten Parodontaltasche zurückzuführen, die ein "dreifaches" Risiko für das Eindringen von Viren darstellt, was häufig vernachlässigt wird. Die exponierte ulzerierte Oberfläche bei Parodontitis wird auf etwa 44 cm2 (= die Hälfte der Handfläche eines Erwachsenen) geschätzt [Heo 2013]. Darüber hinaus sind einige parodontopathogene Bakterien, die mit Parodontitis assoziiert sind, darunter Porphyromonas gingivalis, in der Lage, die Integrität der Schleimhaut weiter zu beeinträchtigen, indem sie die natürliche Immunantwort des oralen Epithels und die epitheliale Barrierefunktion (z. B. Tight Junctions und Adherens Junctions) blockieren [Groeger 2019]. Der Zahnarzt sollte den Patienten daher zu regelmäßigen Munduntersuchungen und Zahnpflegemaßnahmen raten [Chi 2010, Kiran 2005].
Diagnostische Aspekte
Um Menschen mit und ohne Diabetes zu identifizieren, die aufgrund einer Parodontitis ein erhöhtes Risiko für eine schwere COVID-19-Erkrankung haben, ist es von größter Bedeutung, regelmäßige und valide Screening-Maßnahmen zur Erkennung von Zahnfleischerkrankungen durchzuführen. Traditionell werden das Vorhandensein und der Schweregrad einer Parodontitis anhand klinischer Indizes und röntgenologischer Parameter beurteilt, die in erster Linie die Zerstörung des parodontalen Gewebes widerspiegeln [Kinane 2017]. Eine neue Parodontitis-Klassifikation kombiniert seit 2018 den traditionellen Ansatz mit Biomarkern aus Serum und Mundflüssigkeit, um die diagnostische Genauigkeit bei der Früherkennung des Risikos einer parodontalen Erkrankung zu verbessern [Tonetti 2018]. Die Parodontitis-Klassifikation umfasst auch klinische und anatomische Parameter zur Bewertung des Risikos einer Parodontitis-Progression. Diese sind mit der Parodontitis assoziiert und indizieren die Wahrscheinlichkeit eines zukünftigen schweren parodontalen Schadens, können aber nicht als zuverlässig genug angesehen werden, um anzuzeigen, wann sich die Parodontitis in ihrer aktiven Phase befindet. Dies gilt z. B. für die Parameter Rauchen und Diabetes, die bekannte Risikofaktoren für Parodontitis sind [Leite 2018, Cervino 2019, Nascimento 2018]. Die derzeitigen Klassifikations-Parameter können vor allem vorhersagen, dass der parodontale Schaden wahrscheinlich in der Zukunft eintreten wird, aber nicht den genauen Zeitpunkt, zu dem er eintritt. Ein nicht-invasiver Point-of-Care-Assay für einen Entzündungs-Biomarker (aktive Matrix-Metalloproteinase-8; aMMP-8) hat sich in mehreren kürzlich durchgeführten Studien als wertvolle Zusatzmaßnahme zur Messung der parodontalen Taschenbildung an den Indexzähnen erwiesen. Erhöhtes aMMP-8 ist ein funktioneller Biomarker, der mit dem parodontalen Attachmentverlust korreliert [Gul 2020, Leppilahti 2015, Pussinen 2020].
Die aktivierte Matrixmetalloproteinase-8 (aMMP-8, Kollagenase 2) ist ein kollagenolytisches Enzym, das die Zerstörung und Verdauung des vorherrschenden Kollagens (Typ I) im Parodontalgewebe bewirkt [Kuula 2009, Sorsa 2016, Umeizudike 2022]. Erhöhte aMMP-8-Spiegel wurden bei vielen chronischen Systemerkrankungen wie Atherosklerose, Diabetes mellitus, entzündlichen Darmerkrankungen, Asthma und Mundhöhlenkrebs beobachtet [Kuula 2009, Umeizudike 2022]. Das Enzym spielt sowohl beim physiologischen Kollagenumsatz als auch beim pathologischen Gewebeabbau eine wichtige Rolle [Sorsa 2016, Umeizudike 2022, Herr 2007, Nwhator 2014, Sorsa 1990, Sorsa 2020]. Es kommt sowohl in inaktiver als auch in aktiver Form vor, wobei die aktive Form nachweislich einen starken Zusammenhang mit dem Parodontalstatus und eine bessere diagnostische Genauigkeit bei der Erkennung von Parodontalerkrankungen aufweist [Gul 2020, Sorsa 2016, Lee 1995].
Ein Point-of-Care Immunoassay zum Nachweis von aMMP-8 in Mundspülproben wurde entwickelt und in zahlreichen prospektiven Studien in mehreren Ländern eingesetzt, um die Bedeutung von aMMP-8 bei der Erkennung des Fortschreitens von Parodontalerkrankungen und des Attachmentverlusts zu untersuchen [Gul 2020, Leppilahti 2015, Sorsa 2016, Sorsa 2020, Lee 1995, Alassiri 2018, Keskin 2020, Gupta 2023, Mancini 1999, Räisänen 2021, Romanelli 1999]. In einer neueren Untersuchung wurde dieser Mundspültest zusätzlich zum neuen Parodontitis-Staging eingesetzt, um eine aktive Parodontalerkrankung bei COVID-19-Patienten sowie bei nicht betroffenen Personen zu identifizieren. Ein beeinträchtigter Parodontalstatus, wie er durch erhöhte aMMP-8-Werte angezeigt wird, korrelierte bei COVID-19-Patienten signifikant mit der Einweisung in die Intensivstation [Gupta 2022a, Anand 2021]. Darüber hinaus hatten Patienten mit schwerer Parodontitis und erhöhten aMMP-8-Werten ein wesentlich höheres Risiko für eine Krankenhauseinweisung, die Notwendigkeit für eine Beatmung, die Entwicklung einer COVID-19-Pneumonie und eine höhere Sterblichkeit. Diese Ergebnisse sprechen für den aMMP-8-Schnelltest als Screening-Instrument für Parodontitis bei COVID-19-Patienten.
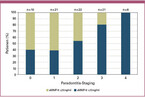
Der aMMP-8-Point-of-Care-Test kann für ein zeitnahes quantitatives Screening von Patienten eingesetzt werden [Sorsa 2016, Umeizudike 2022, Herr 2007, Nwhator 2014, Sorsa 1990, Sorsa 2020]. In einer aktuellen Untersuchung in Deutschland wurden 80 gesunde Probanden, davon viele ohne Anzeichen oder mit nur sehr geringen Symptomen einer Parodontalerkrankung (Stadien 0, 1 und 2 nach der internationalen Klassifikation [Tonetti 2018]), zusätzlich auf erhöhte aMMP-8-Werte in der Mundhöhle untersucht. Ein erheblicher Anteil von 40 % im Stadium 0, 38 % im Stadium 1 und 55 % im Stadium 2 hatte einen aktiven, fortschreitenden destruktiven Parodontitisprozess, der nur durch den Biomarker angezeigt wurde (siehe Abbildung 3; Pfützner Science & Health Institute, Data on file). Zur wirksamen Vorbeugung schwerer COVID-19-Erkrankungen wird daher empfohlen, auch scheinbar gesunde Personen auf das Vorliegen einer parodontalen Entzündung zu untersuchen.
Laut aktuellen systematischen Übersichtsarbeiten ist aMMP-8/MMP-8 derzeit der genaueste diagnostische Biomarker in der gingival-krevikularen Flüssigkeit und im Speichel für Parodontitis bei klinisch gesunden Patienten [Arias-Bujanda 2019, Arias-Bujanda 2020, Kc 2019]. In Anbetracht der oben erwähnten pathophysiologischen Informationen über den Eintritt von COVID-19 in den Körper über die ACE2-Rezeptoren in der Mundschleimhaut ist es bemerkenswert, dass die Speichelkonzentration von ACE2 mit dem Schweregrad und der Komplexität der Parodontitis ansteigt und positiv mit dem Alveolarknochenverlust und der aMMP-8-Konzentration im Speichel korreliert [Zhao 2022].
Schlussfolgerungen
Es besteht eine starke Korrelation zwischen Diabetes mellitus, Parodontitis und einem schweren Verlauf der COVID-19-Erkrankung. Daher erscheint neben den typischen Hygiene-Empfehlungen der offiziellen Gesundheitsorganisationen eine gezielte orale Prävention aufgrund der hohen Anfälligkeit der Mundhöhle für die Bindung von SARS-CoV-2 besonders wichtig. Ziel einer spezifischen oralen Prävention muss es sein, das individuelle Risiko einer COVID-19-Erkrankung bei Patienten mit vorhandener chronischer oraler Entzündungsaktivität und medizinisch anfälligen Patienten mit erhöhtem oralen Risikoprofil, wie z. B. Menschen mit Diabetes mellitus, zu senken. Die Messung von aMMP-8 in einer Mundspülprobe scheint aktuell das wirksamste Diagnoseinstrument für diesen Zweck zu sein.
Manuskript eingegangen: 10. Februar 2023
Manuskript angenommen: 19. April 2023
Interessenkonflikte
Alle Autoren geben hinsichtlich des Inhalts dieses Artikels keine Interessenkonflikte an.
Erschienen in: Diabetes, Stoffwechsel und Herz, 2023; 32 (3) Seite 121-128