Die mehrmals tägliche Messung der Blutglukose gehört zur Behandlungsroutine von Menschen mit Diabetes, die eine intensivierte Insulintherapie durchführen. Auf der Basis der Messergebnisse werden auf der ganzen Welt täglich millionenfach Therapieentscheidungen gefällt, die einen Einfluss auf das akute und langfristige Wohlbefinden der betroffenen Personen haben [American Diabetes Association 2024].
Zusammenfassung
Bei einem neuen Sensor zur kontinuierlichem Glukosesemessung wird die Glukosekonzentration im Gewebe in einer winzigen osmotischen Druckkammer in einen physikalisch messbaren Druck umgewandelt, der durch Druckwandler in ein elektrisches Signal überführt wird. Das Ziel dieser Entwicklung ist ein implantierbares Medizinprodukt in der Größe eines Reiskorns. Die Miniaturisierung wurde nun mit nanogranularen Widerstandssensoren (NTR-Sensoren) ermöglicht, eine weitere fast 100-fache Verkleinerung der Druckkammer wurde möglich.Zum Überprüfen der Sensor-Funktionalität füllten wir die miniaturisierte Kammer mit Rinderserumalbumin (BSA, 1 mM) und setzten sie im Wechsel destilliertem Wasser und einer 1 mM BSA-Lösung aus. Anschließend stellten wir Sensoren mit Glukose-Testchemie (Concanavalin A/Dextran) her und untersuchten die Sensorleistung bei dynamischen Glukoseänderungen zwischen 0 und 300 mg/dl. Die Auswertung der Daten ergab zuverlässige und reproduzierbare Druckänderungen. Für erste Humanexperimente für die Algorithmusentwicklung wurde der Sensor in eine Trokarnadel eingebaut und bei gesunden Freiwilligen in das abdominelle Fettgewebe eingebracht. Hierbei gab es erste vielversprechende humane Glukose-Vergleichsdaten mit einer kapillären Referenzmethode.Zusammenfassend lässt sich sagen, dass die NTR-Drucksensortechnologie erfolgreich eingesetzt wurde, um die Größe der zentralen osmotischen Druckkammer um mehr als 95 % zu verringern, ohne dass das osmotische Drucksignal beeinträchtigt wurde. SchlüsselwörterGlukosesensor, Nanotechnologie, NTR-Sensoren
Miniaturization of an Osmotic Pressure-Based Continuous Glucose Sensor using Nanotechnology
Summary
In a new sensor for continuous glucose measurement, the glucose concentration in the tissue is converted into a physically measurable pressure in a tiny osmotic pressure chamber, which is converted into an electrical signal by pressure transducers. The aim of this development is an implantable medical device with the size of a grain of rice. Miniaturization has now been made possible with nanogranular resistance sensors, allowing the pressure chamber to be reduced almost 100-fold.To test the sensor functionality, we filled the miniaturized chamber with bovine serum albumin (BSA, 1 mM) and exposed it alternately to distilled water and a 1 mM BSA solution. We then prepared sensors with glucose test chemistry (concanavalin A/dextran) and examined the sensor performance at dynamic glucose changes between 0 and 300 mg/dl. The evaluation of the data showed reliable and reproducible pressure changes. For initial human experiments for algorithm development, the sensor was installed in a trocar needle and inserted into the abdominal fat tissue of healthy volunteers. This yielded the first promising human glucose comparison data with a capillary reference method.In summary, the NTR pressure sensor technology was successfully used to reduce the size of the central osmotic pressure chamber by more than 95 % without compromising the osmotic pressure signal. Keywords
glucose sensor, nanotechnology, NTR sensor
Einleitung
Neben den blutigen und schmerzhaften Einzelmessungen erfreuen sich Nadelsensoren zur kontinuierlichen Glukosemessung im interstitiellen Fettgewebe (CGM, continuous glucose measurement) zunehmender Beliebtheit. Moderne Nadelsensoren wandeln – wie die Blutzuckerteststreifen – die Glukose elektrochemisch mithilfe von Enzymen (Glukoseoxidase oder Glukosedehydrogenase) in ein Messsignal um, das 12- bis 20-mal pro Stunde drahtlos zu einem Empfängergerät oder einem Smartphone übertragen wird. Der erste CGM-Sensor für (damals noch) diagnostische Zwecke wurde zu Beginn dieses Jahrtausends vom Unternehmen MiniMed auf den Markt gebracht. Er war noch verkabelt, konnte drei Tage lang eingesetzt werden und musste mehrmals am Tag mittels Vergleichsmessungen kalibriert werden, um vernünftige Werte zu erzielen [Zick 2000]. Seither hat sich die CGM-Technologie massiv verbessert. Die Sensoren wurden kleiner und genauer und eine Tragedauer von 10 bis 14 Tagen haben sie zu beliebten und häufig genutzten Hilfsmitteln für Menschen mit Typ-1- oder Typ-2-Diabetes gemacht [American Diabetes Association 2024].
Da die Menge der verfügbaren Glukoseinformationen durch die CGM-Systeme dramatisch angestiegen ist, konnten neue Kriterien für die Qualität der Glukoseeinstellung definiert und in die praktische Therapie eingeführt werden, die mehr Informationen bieten als der HbA1c-Wert (z. B. Anteil der Messungen im Zielbereich, Time in Range [TIR] [DiMolfetta 2023]). Glukosegrenzwerte für Hypoglykämie und Hyperglykämie können individuell eingestellt werden und die Geräte geben Alarm, wenn diese Grenzen unter- oder überschritten werden. Dadurch führte der vermehrte Einsatz von CGM-Sensoren zu weniger Hypoglykämien und Hyperglykämien und schlussendlich zu einer höheren Lebensqualität der Anwender [Aleppo 2017, Beck 2017a und 2017b, Bolinder 2016, Chaleer 2018 und 2020, Fokkert 2019, Heinemann 2018, Joubert 2012, Lind 2017].
Es verbleibt dennoch die Notwendigkeit, die Sensoren alle 10 bis 14 Tage zu wechseln, und es gibt durchaus Probleme mit Interferenzen und bei der Genauigkeit [Shapiro 2017, Heinemann 2022, Pfützner 2024]. Daher verbleibt weiterhin der medizinische Wunsch nach kleineren Sensoren mit verbesserter Funktionalität. Idealerweise sollte der Sensor implantierbar sein und für mehrere Jahre genutzt werden können. Um für alle Betroffenen verfügbar zu werden, sollte er preiswert und umweltschonend sein, denn die aktuellen Sensoren sind noch kostenintensiv und verursachen eine beträchtliche Menge an Plastikmüll und Elektroschrott.
Dies zu erreichen, ist das Ziel einer aktuellen Entwicklung eines norwegischen Medizinprodukteunternehmens (Lifecare ASA, Bergen, Norwegen). Der finale Glukosesensor (Sencell) soll klein und implantierbar sein und mit drahtloser Energieversorgung und drahtlosem Datentransfer für mindestens 6 bis 12 Monate einsetzbar sein. Der Sensor arbeitet mit einer osmotischen Drucktechnologie, bei der die wechselnden Glukosekonzentrationen außerhalb des Sensors zu wechselnden osmotischen Drücken im Inneren des Sensors führen. Das Grundprinzip des osmotischen Sensors wurde bereits vor einiger Zeit durch Johannessen et al. publiziert [Johannessen 2010], aber die damaligen Prototypen waren zu groß (5 x 5 x 2 cm) und hatten eine zu lange Reaktionszeit (45 – 60 min) für einen klinischen Einsatz.
Das Ziel der aktuellen Sencell-Entwicklung ist ein implantierbarer Sensor mit der Größe eines Reiskorns, einer Reaktionszeit von wenigen Minuten und einer Tragedauer von mindestens 6 bis 12 Monaten. Der Sensor könnte am Unterarm z. B. unter eine entsprechend angepasste Smartwatch implantiert werden, die den Sensor mit induktiver Energie versorgt und die Daten ausliest und analysiert. Sollte eine Explantation des Sensors notwendig werden, soll diese mit einem eigens entwickelten medizinischen Gerät einfach und problemlos durchgeführt werden können.
In dieser Veröffentlichung berichten wir über die Fortschritte, mit der die notwendige Miniaturisierung der Kerntechnologie des Sensors erreicht werden konnte (Größe der Druckkammer: 1 x 0,5 x 0,25 mm), und über erste Ergebnisse von präklinischen und klinischen Versuchen.
CGM: continuous glucose measurement
FEBID: fast electron-beam induced deposition
GBM: glukosebindendes Molekül
GL: glukoseähnlicher Ligand
MARD: mittlere absolute relative Abweichung
NTR-Sensoren: nanogranulare Tunneling-resistive Sensoren
TIR: Time in Range
Die Messtechnologie
Für die Glukosemessung wird eine osmotische Druckkammer benötigt, die durch eine semipermeable Membran mit kleinsten Poren (Durchmesser ca. 5 nm) von der interstitiellen Flüssigkeit getrennt ist. Im Inneren der Kammer befindet sich ein großes glukosebindendes Molekül (GBM) mit speziellen Glukosebindungsstellen und ein Makromolekül, das stellvertretend für die Glukose an die Bindungsstellen andocken kann (glukoseähnlicher Ligand, GL). GBM und GL werden jeweils durch ihre Größe daran gehindert, die Druckkammer zu verlassen. Glukose hingegen kann als kleines Molekül problemlos durch die semipermeable Membran in die Kammer ein- und aus der Kammer austreten. Wenn keine Glukose vorhanden ist, verbinden sich GBM und GL durch elektrostatische Wechselwirkungen zu einem Komplex, der eine Osmolarität von 1 aufweist (1 osmotisch aktives Teilchen). Sobald Glukose in die Kammer diffundiert, verdrängt sie den GL aus der Bindung, da sie eine etwas höhere Bindungsaffinität zum GBM aufweist. Hierdurch werden beide Großmoleküle GBM und GL getrennt für sich osmotisch aktiv (2 osmotisch aktive Teilchen). Diese stoßen sich jetzt elektrostatisch ab. Da sie nicht aus der Kammer austreten können, steigt der osmotische Druck im Inneren an. Auch die Bindung der Glukose an das GBM ist reversibel und das System ist bindungsdynamisch so austariert, dass ein Absinken der Glukosekonzentrationen im Interstitium dazu führt, dass die Glukose die GBM-Bindung verlässt und durch die semipermeable Membran die Kammer verlässt. Hierdurch können sich GBM und GL wieder verbinden und der osmotische Druck nimmt ab. Da das System ausschließlich mit vollständig reversiblen Affinitätsbindungen arbeitet und somit kein Molekül zum Generieren des Messsignals beschädigt wird, ist theoretisch eine unendliche Lebensdauer dieser Messtechnologie wahrscheinlich [Johannessen 2010, Pfützner 2023].
Der osmotische Druck wird durch Druckwandler im Inneren der Kammer erfasst. In früheren Jahren wurden hierfür die kleinsten kommerziell erhältlichen piezoresistiven Drucksensoren verwendet und es war dadurch möglich, das Volumen der osmotischen Druckkammer auf 70 µl zu verkleinern (siehe Abb. 1).
 Abb. 1: Laborversion und präklinische Sensorprototypen mit piezoresistiven Druckwandlern (obere Reihe) und Prototypen, die durch die weitere Miniaturisierung mit Nanosensortechnologie ermöglicht wurden (untere Reihe).
Abb. 1: Laborversion und präklinische Sensorprototypen mit piezoresistiven Druckwandlern (obere Reihe) und Prototypen, die durch die weitere Miniaturisierung mit Nanosensortechnologie ermöglicht wurden (untere Reihe).
Diese ersten Prototypen wurden für In-vitro-Experimente und für präklinische Pilotversuche mit Schweinen eingesetzt. Nach Einführung einer zweiten Referenzdruckkammer (gleiche Bauart, aber ohne das GBM) konnte bereits bei den Rohdaten eine Korrelation mit den interstitiellen Glukosewerten beobachtet werden (Abb. 2). Diese präklinischen Prototypen waren zu groß, um bei Menschen einen sinnvollen klinischen Einsatz zu ermöglichen. Zu diesem Zeitpunkt der Entwicklung wurde die Drucksensorik zum limitierenden Faktor, denn eine weitere Miniaturisierung der piezoresistiven Druckwandler hätte zum Verlust einer ausreichenden Sensitivität geführt. Eine neue Methode zur Messung des osmotischen Drucks musste gefunden werden.
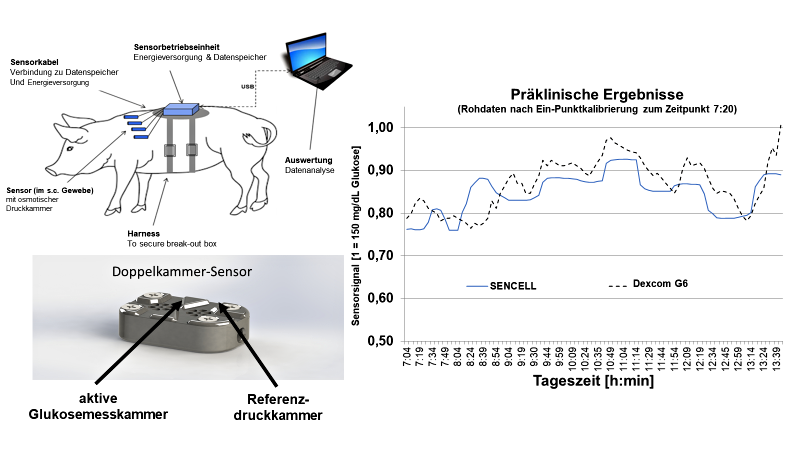 Abb. 2: Skizze zum Versuchsaufbau der präklinischen Pilotstudien mit einem Beispiel zur Korrelation der Rohdaten mit den Referenzglukosewerten nach einmaliger Kalibrierung mittels eines kommerziell verfügbaren CGM-Nadelsensors.
Abb. 2: Skizze zum Versuchsaufbau der präklinischen Pilotstudien mit einem Beispiel zur Korrelation der Rohdaten mit den Referenzglukosewerten nach einmaliger Kalibrierung mittels eines kommerziell verfügbaren CGM-Nadelsensors.
Nanogranulare Tunneling-resistive (NTR) Sensoren
Im Jahr 2016 publizierten Dukic et al. einen Bericht über die Herstellung und die physikochemischen Eigenschaften eines Drucksensors mit einer Größe von wenigen Nanometern [Dukic 2016]. Diese Sensoren werden in einem umgebauten Elektronenmikroskop mittels atomarer Materialabscheidung hergestellt (FEBID: fast electron-beam induced deposition). Das patentierte Verfahren (nano3Dsense®, NanoScale Systems, Darmstadt) wurde von Lifecare einlizensiert und konnte damit für die weitere Sencell-Entwicklung angewendet werden. Bei diesem Verfahren werden herkömmliche Elektronenrastermikroskope mit einem Gasinjektionssystem aufgerüstet. Ein hochenergetischer Elektronenstrahl wird auf den Ort der geplanten Sensorabscheidung ausgerichtet. Von der Seite strömt gleichzeitig ein metalloorganisches Gas ebenfalls über diese geplante Abscheidungsstelle. An der Stelle der höchsten Elektronendichte dissoziieren die metalloorganischen Moleküle wieder in ihre festen Ausgangsstoffe, die an dieser Stelle abgelagert werden (Abb. 3).
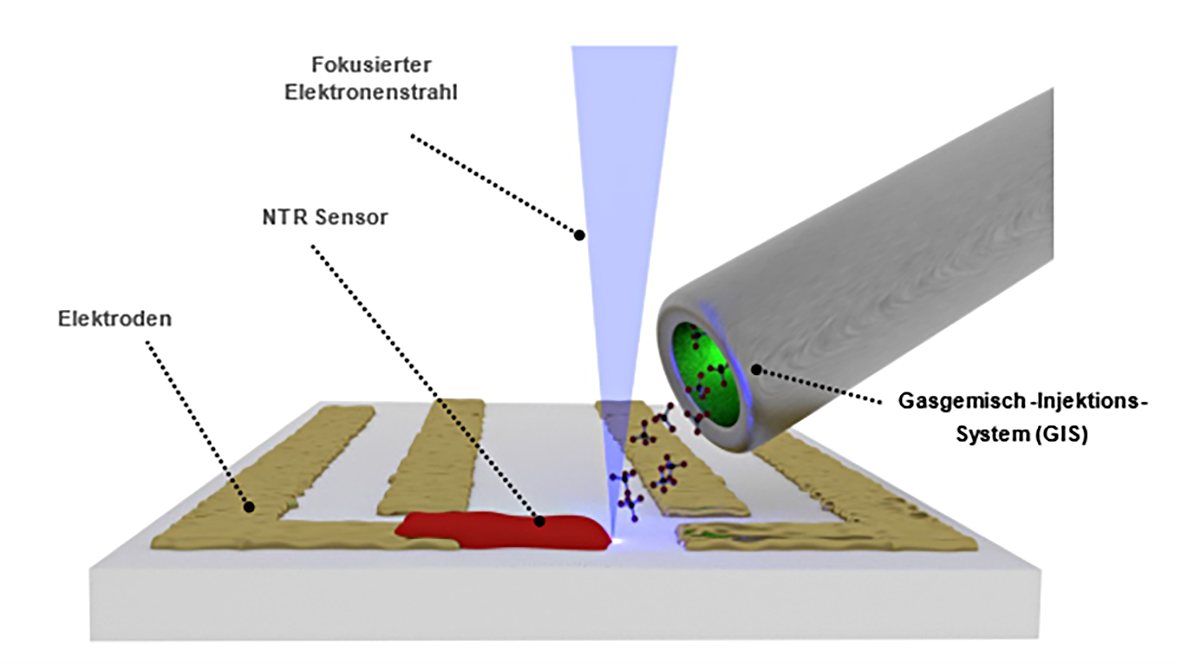 Abb. 3: Schematische Darstellung der Methode zur atomaren Materialabscheidung (Fast Electrone-Beam Induced Deposition, FEBID).
Abb. 3: Schematische Darstellung der Methode zur atomaren Materialabscheidung (Fast Electrone-Beam Induced Deposition, FEBID).
Bei entsprechender Auswahl der gasförmigen organometallischen Verbindungen entsteht z. B. ein Kohlenstoffband, in das metallische Granulome eingebunden sind [Huth 2021]. Die finale Größe und auch die dreidimensionale räumliche Struktur der entstehenden NTR-Sensoren kann durch eine entsprechende Software-Steuerung genau an die vorhandenen Notwendigkeiten angepasst werden.
Bei den aktuellen Sencell-Versionen befindet sich der NTR-Sensor auf einer beweglichen Membran (Druckmembran), die die osmotische Druckkammer unten abschließt (Abb. 4). Der Sensor überbrückt einen kleinen Spalt zwischen zwei Goldelektroden. Ein Druckanstieg führt zu einer Bewegung und Dehnung der Druckmembran, was eine Widerstandsänderung im Sensorelement verursacht, das in eine "Wheatstone"-Brücke integriert ist. Die Verwendung dieser Sensortechnologie ermöglichte bislang bereits die Miniaturisierung der osmotischen Druckkammer auf ein Volumen von 750 nl und die Reduktion der Betriebsspannung auf 100 mV.
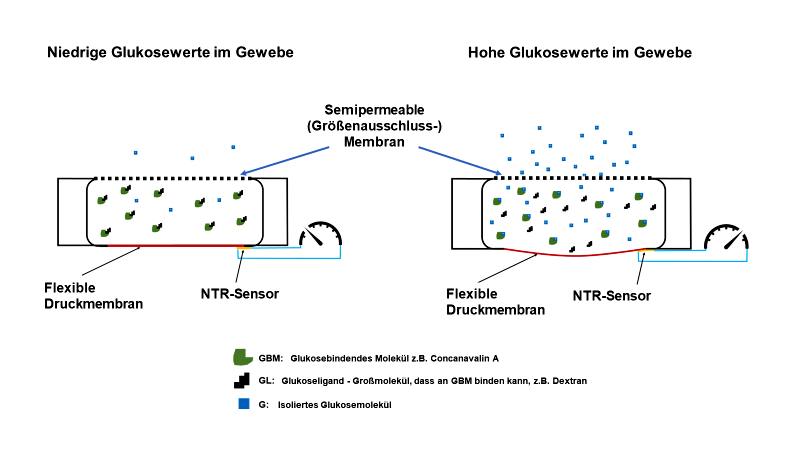 Abb. 4: Skizze des auf osmotischem Druck basierenden Glukosesensors mit Erläuterung der Messbedingungen bei niedrigen und hohen Glukosekonzentrationen in der interstitiellen Flüssigkeit.
Abb. 4: Skizze des auf osmotischem Druck basierenden Glukosesensors mit Erläuterung der Messbedingungen bei niedrigen und hohen Glukosekonzentrationen in der interstitiellen Flüssigkeit.
Für die In-vitro- und präklinischen In-vivo-Versuche wurde das Signal des Sensorsystems direkt mit einem Voltmeter (Keithley DMM6500, Tektronix, Beaverton, OR) ausgelesen. Das Sensorsystem verwendet keinen Vorverstärker und wird mit einem stabilen, rauscharmen 100-mV-Spannungsregler auf der Basis eines LT3042-Chips für analoge Geräte betrieben. Die aufgezeichneten Daten werden über einen selbstgeschriebenen Python-Code gespeichert, der auch ein separates Fenster für eine Echtzeit-Datenvisualisierung bietet. Nach dem Experiment wurden die Daten als Standard-csv-Datei gespeichert und mit Standard-Analyse-Software weiterverarbeitet.
Ergebnisse
Osmotischer Druck-Benchmark-Test
Die Funktionalität der In-vitro-Sensorprototypen mit piezoresistiver Druckmessung wurde zunächst in einem Benchmark-Test geprüft, bei dem die Kammer mit 1 mM Albumin in einer physiologischen NaCl-Lösung gefüllt wurde. Die Exposition dieser Sensoren in destilliertem Wasser hatte zuvor zu einem Druckanstieg von ca. 30 mbar geführt und die anschließende Exposition in 1 mM Albuminlösung führte zu einem Druckabfall zurück zum Ausgangswert (Abb. 5a). Es ist bekannt, dass der osmotische Druck unabhängig vom Kammervolumen ist, und mit demselben Protokoll lieferten die miniaturisierten ebenfalls mit 1 mM Albuminlösung gefüllten Sensoren ähnliche Ergebnisse, wenn sie der gleichen Reihenfolge von Testlösungen ausgesetzt wurden (Abb. 5b). Zur Bestätigung der Daten wurden alle Experimente mindestens in dreifacher Ausführung wiederholt.
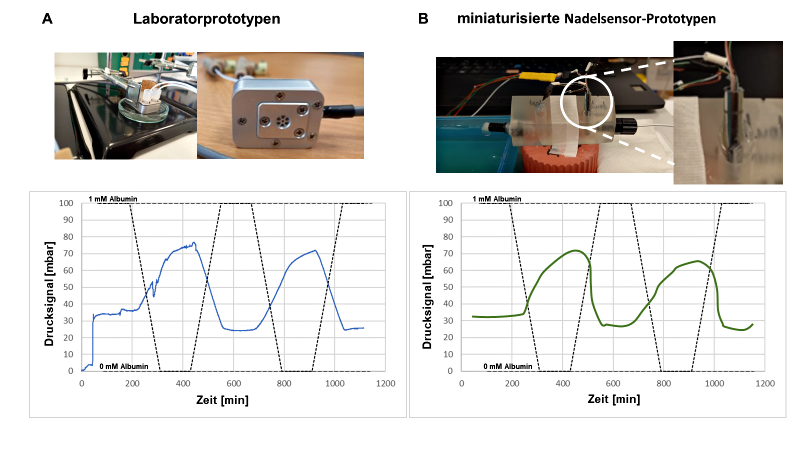 Abb. 5: Druckänderungen im Inneren der Osmosekammern bei Exposition der osmotischen Sensoren (nach Füllung mit 1 mM Albuminlösung) mit destilliertem Wasser bzw. 1 mM Albumin. A: Ergebnisse mit den Laborprototypen unter Verwendung piezoresistiver Druckwandler; B: Ergebnisse mit der miniaturisierten Kernsensoreinheit unter Verwendung von NTR-Sensoren.
Abb. 5: Druckänderungen im Inneren der Osmosekammern bei Exposition der osmotischen Sensoren (nach Füllung mit 1 mM Albuminlösung) mit destilliertem Wasser bzw. 1 mM Albumin. A: Ergebnisse mit den Laborprototypen unter Verwendung piezoresistiver Druckwandler; B: Ergebnisse mit der miniaturisierten Kernsensoreinheit unter Verwendung von NTR-Sensoren.
Auf der Grundlage dieser Ergebnisse wurden die miniaturisierten Sensoren mit der chemischen Flüssigkeit für einen aktiven Glukosesensor hergestellt (Concanavalin A/Dextran [Johannessen 2010]. In einem Labormodell für dynamische Glukoseveränderungen, das wir für die Testung von CGM-Sensoren entwickelt haben [Pfützner 2024], wurden diese Glukosesensoren auf ihre Fähigkeit überprüft, Glukoseschwankungen zu erfassen und anzuzeigen. Auch bei diesen Versuchen waren die Ergebnisse vergleichbar zwischen der Sencell-Laborversion und der miniaturisierten Variante (Abb. 6). Die Druckänderungen waren reproduzierbar und es wurde eine lineare Beziehung zwischen dem Sensorsignal und den unterschiedlichen Glukosekonzentrationen im Überstand beobachtet.
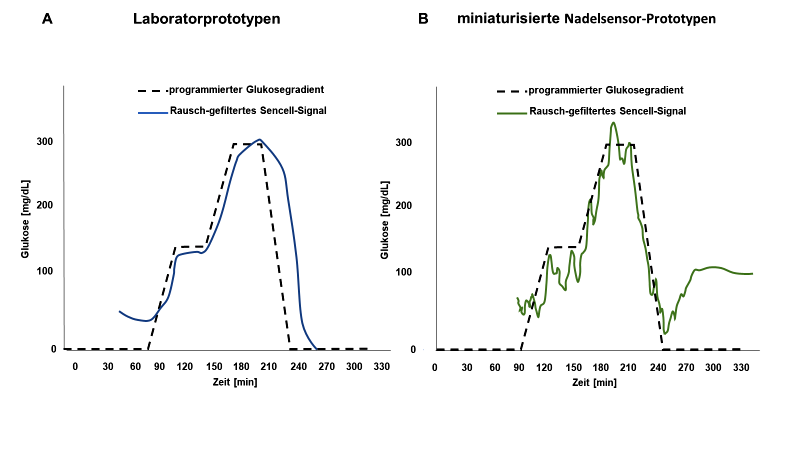 Abb. 6: Messsignale der aktiven Glukosesensorversionen bei stufenweiser dynamischer Veränderung der Glukosekonzentration im Messkanal von 2 mM auf 15 mM und 30 mM sowie einstufiger Reduktion zurück auf 0 mM. Die gestrichelte Linie zeigt den einprogrammierten Glukosegradienten und die durchgezogene Linie das jeweilige kalibrierte Sensorsignal. A: Ergebnisse mit den präklinischen Prototypen (piezoresistive Druckwandler), B: Ergebnisse mit den miniaturisierten Sensoren (NTR-Druckwandler). Die zeitliche Verzögerung der Messsignale ergibt sich durch das Totvolumen der Leitungen von der Gradientenpumpe bis zum Erreichen des jeweiligen Sensors.
Abb. 6: Messsignale der aktiven Glukosesensorversionen bei stufenweiser dynamischer Veränderung der Glukosekonzentration im Messkanal von 2 mM auf 15 mM und 30 mM sowie einstufiger Reduktion zurück auf 0 mM. Die gestrichelte Linie zeigt den einprogrammierten Glukosegradienten und die durchgezogene Linie das jeweilige kalibrierte Sensorsignal. A: Ergebnisse mit den präklinischen Prototypen (piezoresistive Druckwandler), B: Ergebnisse mit den miniaturisierten Sensoren (NTR-Druckwandler). Die zeitliche Verzögerung der Messsignale ergibt sich durch das Totvolumen der Leitungen von der Gradientenpumpe bis zum Erreichen des jeweiligen Sensors.
Die Ergebnisse der miniaturisierten Sensoren (Abb. 5b) zeigen, dass das Signal-Rausch-Verhältnis proportional zur Größe der Druckmembran schwächer wird, was zu einer ausgeprägteren Variabilität der Stromanzeige führt. Die erhöhten Signale bei einer (unphysiologischen) Glukosekonzentration von 0 mg/dl zu Beginn (A) bzw. am Ende (B) der Experimente sind Artefakte, die durch den verwendeten Standard-Glättungsfilter verursacht werden, der über Frequenzen wirkt (Butterworth-Filter). Ein optimierter Algorithmus zur Beseitigung solcher Artefakte wird entwickelt, sobald klinische Ergebnisse an Menschen verfügbar sind.
Die Verzögerung zwischen den eingesetzten und den gemessenen Glukosekonzentrationen bei den In-vitro-Experimenten wird durch die Zeit verursacht, die benötigt wird, um die programmierten Glukosespiegel durch das Totraumvolumen der Schläuche von der Pumpe zu den Sensoren zu befördern. Nach Korrektur für diese Zeitverschiebung bestätigte eine Parkes-Error-Grid-Analyse [Parkes 2000, Pfützner 2013] (vs. YSI STAT2300 Plus Glucose Analyzer als Referenzmethode, YSI Inc., Yellow Springs, OH) eine Genauigkeit der Sensoren, die sich dieser in-vitro-experimentellen Methodik als vergleichbar mit kalibrierten, kommerziell verfügbaren Nadelsensoren für die klinisch relevanten Glukosebereiche (50 bis 300 mg/dl) darstellt (100 % der Datenpunkte in den unkritischen Zonen A und B des Parkes-Error-Grid).
In einem klinischen Pilotversuch konnten (mit Zustimmung der zuständigen Ethikkommission und der Behörden) erstmals Sensorprotoypen, die – noch verkabelt – in eine Trokarnadel eingebettet waren, bei Probanden mit und ohne Diabetes getestet werden. Ziel dieser ersten Versuche war es, klinische Daten für die weitere Entwicklung des Auswertungs-Algorithmus zu erhalten. Bereits bei der initialen retrospektiven Analyse mit bioinformatischen Standardverfahren und im Vergleich mit einer teststreifenbasierten Referenzmethode (StatStrip) und einem kommerziell erhältlichen CGM-Sensor (Dexcom G6) zeigten sich sehr gute Übereinstimmungen bei den unterschiedlichen Messmethoden. Ein Beispiel von einem Mahlzeitenexperiment zeigt Abbildung 7.
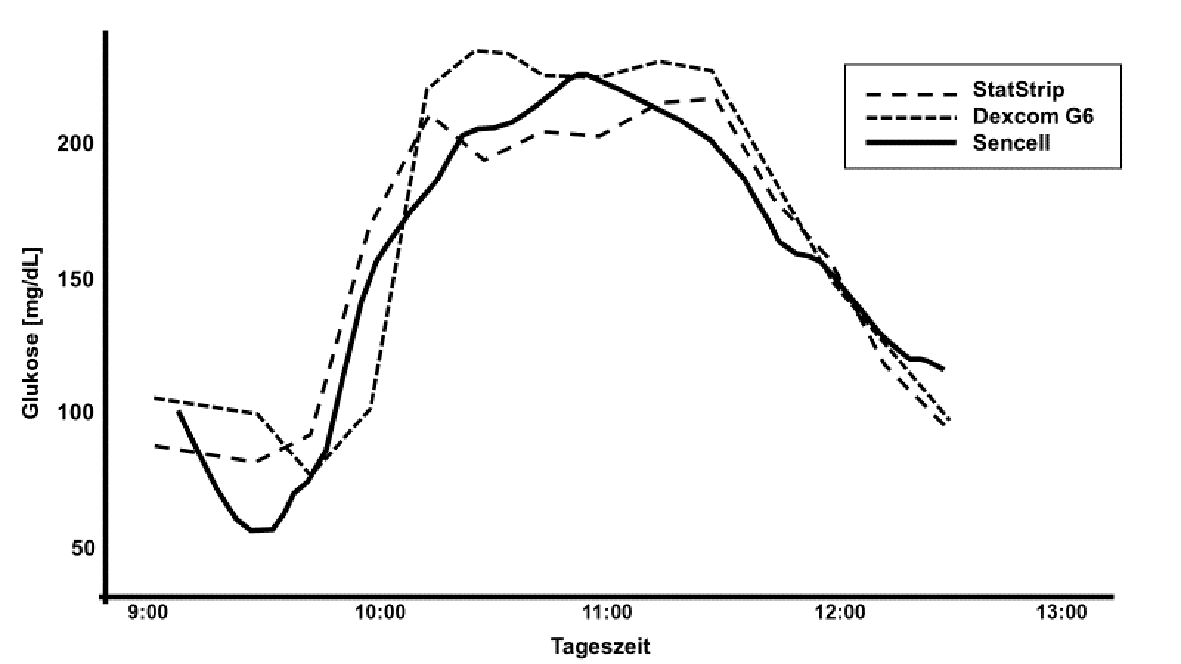 Abb. 7: Erste Humanergebnisse: Verkabelte Nadelversionen eines osmotischen Glukosesensors wurden zum Gewinnen von Daten für die Algorithmusentwicklung bei Probanden subkutan insertiert. Die retrospektive initiale Auswertung eines Mahlzeitenexperiments zeigt eine gute Übereinstimmung der Messsignale.
Abb. 7: Erste Humanergebnisse: Verkabelte Nadelversionen eines osmotischen Glukosesensors wurden zum Gewinnen von Daten für die Algorithmusentwicklung bei Probanden subkutan insertiert. Die retrospektive initiale Auswertung eines Mahlzeitenexperiments zeigt eine gute Übereinstimmung der Messsignale.
Diskussion
Das Prinzip der Osmose und die Nutzung des osmotischen Drucks zur Stabilisierung biologischer Strukturen, z. B. biologischer Zellen, ist ein in der Natur weitverbreitetes Phänomen. Wie aus der Formel π = I × M × r × T (wobei "π" der osmotische Druck, "I" der Van-’t-Hoff-Faktor, "M" die molare Konzentration der Teilchen in Lösung, "R" die ideale Gaskonstante und "T" die Temperatur in Kelvin ist) ersichtlich ist, ist der osmotische Druck nicht vom Volumen abhängig. Theoretisch könnte die zentrale Sensortechnologie daher auf eine Größe im Bereich von 100 nm miniaturisiert werden, ohne dass die allgemeine Genauigkeit und Sensitivität verloren geht. Es gibt jedoch mehrere Gründe, die dafür sprechen, dass Miniaturisierungspotenzial nicht komplett auszureizen:
- Erstens muss ein injizierbarer Glukosesensor immer noch gut sichtbar und einfach zu handhaben sein, damit er in der Arztpraxis eingesetzt werden kann.
- Zweitens wird Platz benötigt, um einen ASIC (application-specific integrated circuit, integrierter elektronischer Schaltkreis mit maßgeschneiderter Funktionalität) zur Energieinduktion und Datenübertragung an eine Ausleseeinheit anzubringen.
- Drittens muss das Herstellungsverfahren die Handhabung der Sensoren während einer vollautomatischen Massenproduktion ermöglichen, die das Befüllen der Osmose-Druckkammer mit der Glukose-Messflüssigkeit und das Verschließen der Kammer umfasst.
- Außerdem kann es beim klinischen Einsatz gelegentlich erforderlich sein, einen nicht funktionsfähigen Sensor zu einem späteren Zeitpunkt wieder zu entfernen. In einem solchen Fall muss die Geometrie des Sensors so beschaffen sein, dass dies problemlos möglich ist.
- Abschließend muss das Messverfahren zur Messung osmotischer Druckänderungen unter allen Umgebungsbedingungen zuverlässig sein, z. B. bei Änderungen des Umgebungsdrucks oder der Umgebungstemperatur.
Während der osmotische Druck, wie oben erwähnt, unabhängig vom Volumen ist und somit in einem 100-Liter-Fass und in einer menschlichen Zelle gleich sein sollte (solange Temperatur und Flüssigkeitszusammensetzung [Molekülart und -konzentration] innerhalb und außerhalb der Druckkammer identisch sind), ist ein größenbegrenzender Faktor die Methode, die für die Umsetzung der osmotischen Druckänderung in ein elektrisches Signal verwendet wird. In der aktuellen Version des Glukosesensors wurde die Druckmessung ein Schlüsselfaktor für die weitere Miniaturisierung des Sensors. Piezoresistive Druckwandler verlieren an Empfindlichkeit, wenn sie eine bestimmte Größe unterschreiten [Song 2021, Jafarizadeh 2022], was ihre Verwendbarkeit bei der Entwicklung eines Glukosesensors einschränkt. Diese Situation zwang zu einer Suche nach alternativen Drucksensoroptionen. Eine umfassende Literaturrecherche half, NTR-Sensoren als eine überzeugende Alternative zu identifizieren, um das gewünschte Ziel eines etwa reiskorngroßen Glukosesensors zu erreichen.
Die NTR-Strukturen lassen sich – bei vorhandener apparativer Ausstattung – durch vollautomatische FEBID mit einem Nano3DSense-3D-Druckverfahren, das den Einsatz von Mehrstrahl-Elektronenmikroskopen ermöglicht, in großem Maßstab auf einem Wafer herstellen. Darüber hinaus können die Sensoren auf beliebige Materialien gedruckt werden. Die erforderliche Betriebsspannung im Bereich von 100 mV oder darunter kann durch verschiedene drahtlose Energieinduktionstechnologien bereitgestellt werden. Schließlich erlauben die Technologie und die damit verbundenen elektronischen Anforderungen die Nutzung bestehender und kommerziell verfügbarer Lösungen für die drahtlose Datenübertragung und die Messergebnisse können auf benutzerfreundliche Weise angezeigt werden, z. B. durch eine App auf einem Smartphone.
Die Entwicklung von implantierbaren interstitiellen Glukosesensoren und auch von nicht invasiven Glukosemessgeräten ist in den letzten Jahrzehnten zu einem wichtigen Ziel in der Diabetestechnologie geworden. Zu den physikalischen Verfahren und Methoden, die zum Erfassen spezifischer Glukosesignale in Blut, Gewebe, Speichel, Netzhautflüssigkeit und anderen Organen verwendet werden, gehören unter anderem (Nah-/Mittel-)Infrarot-Spektroskopie, photoakustische Spektroskopie, Terahertz-Spektroskopie, Qu-basierte Resonanz-Mikrowellen-Sensorik, Raman-Spektroskopie, Radioimpedanz-Spektroskopie, optische Rotation und Kombinationen davon [Chen 2017, Juan 2021, Pfützner 2019]. Dabei benötigen nicht invasive Verfahren bislang weiterhin eine regelmäßige invasive Kalibrierung. Ähnlich wie bei den minimal invasiven Nadelsensoren können die von diesen Geräten gelieferten Informationen verzögert sein (15 – 20 Minuten), da die Blutglukose erst über die bekannten dynamischen Gleichgewichtsreaktionen in das interstitielle Gewebe diffundieren muss, was die Genauigkeit dieser Geräte in Notfallsituationen einschränkt. Je nach zugrundeliegender Messtechnologie können nicht invasive Geräte für zusätzliche Störquellen anfällig sein, wie Unterschiede in den Hauteigenschaften, Veränderungen der Mikrozirkulation und der individuellen Blutversorgung, Interferenzen mit Medikamenten oder Nahrungsbestandteilen, Begleiterkrankungen etc. Aus diesen und anderen Gründen haben die meisten nicht invasiven Technologien bisher nicht den erforderlichen Genauigkeitsstandard erreicht, der für eine behördliche Zulassung und den klinischen Einsatz notwendig ist. Mit der raschen Entwicklung von tragbaren Technologien und transdermalen Biosensoren wird die nicht invasive (Blut-)Glukosemessung jedoch wahrscheinlich effizienter, erschwinglicher, robuster und auf dem Markt wettbewerbsfähig werden [Tang 2020].
Derzeit ist nur ein implantierbarer Glukosesensor auf dem Markt erhältlich, der für eine Dauer von bis zu 90 Tagen (in den USA) bzw. bis zu 180 Tagen (in der EU) zugelassen ist (Eversense, Ascensia Diabetes Care). Der Sensor misst alle fünf Minuten die Glukosekonzentration in der Zwischenzellflüssigkeit und zeigt die Messwerte auf einem Smartphone an [Joseph 2021]. Das Gerät arbeitet mit fluorometrischer Glukosemessung und hat dabei einen Durchmesser von von 3,3 mm und eine Länge von 15 mm. Der Sensor wird unter lokaler Betäubung von einer geschulten medizinischen Fachkraft in das subkutane Gewebe des Oberarms implantiert. Das Sensorsignal weist jedoch eine allgemeine Drift auf und erfordert weiterhin etwa alle 12 Stunden eine herkömmliche Blutglukosemessung zur Kalibrierung, um die Glukose zuverlässig zu messen (mittlere absolute relative Abweichung [MARD]: 8,5 – 11,5 %). Dieses CGM-System soll die Blutzuckermessung bei der Entscheidung über die Diabetesbehandlung ersetzen, es muss aber in seiner Messleistung robuster werden, um dieses Ziel zu erreichen [Kropff 2017, Aronson 2019, Christiansen 2019, Jafri 2020]. Die Eversense-Sensoren müssen nach maximal sechs Monaten Gebrauch entfernt werden, was einen Hautschnitt und eine Dissektion erfordert, um den Sensor im subkutanen Gewebe und der ihn umgebenden Faserkapsel zu identifizieren. In der Praxis kann dies ein schwieriges Verfahren sein und die Hilfe eines Chirurgen erfordern, insbesondere wenn der Sensor während des Gebrauchs durch das Gewebe gewandert ist [Joseph 2021]. Die Vorteile dieses implantierbaren Systems überwiegen möglicherweise trotzdem die kurzfristigen Unannehmlichkeiten nach der Implantation sowie die weiteren Risiken (Infektionen, Hämatome, Hautreizungen, Unannehmlichkeiten eines vorzeitigen Sensorausfalls etc. [Joseph 2021]). Es sind jedoch weitere Anstrengungen zum Verbessern der Leistung dieses Geräts erforderlich. Es besteht eindeutig ein medizinischer Bedarf an weiteren alternativen implantierbaren Technologien zur Glukosemessung im Gewebe. Diese ist eine Triebfeder dafür, die Entwicklung des zuvor beschriebenen osmotischen Drucksensors fortzusetzen.
Zusammenfassend lässt sich sagen, dass die Miniaturisierung des Kernsensorelements des auf osmotischem Druck basierenden kontinuierlich messenden Sencell-Glukosesensors zur möglichen Verkleinerung des Medizinprodukts bis auf Reiskorngröße erreicht wurde, indem die früheren piezoresistiven Druckwandler durch NTR-Sensoren mit einer Größe im Bereich von 100 nm ersetzt wurden. Erste klinische Pilotergebnisse mit verkabelten Sencell-Sensorprototypen sind ermutigend für die weitere Entwicklung hin zu einem drahtlosen implantierbaren Minisensor zur kontinuierlichen Glukosemessung im Gewebe.
Alle Abbildungen: Andreas Pfützner
|
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2024; 33 (4) Seite 195-201


