In Deutschland waren im Jahr 2023 etwa 372 000 Menschen von Typ-1-Diabetes betroffen [Deutsche Diabetes Gesellschaft 2024]. Es ist wahrscheinlich, dass diese Zahl in den kommenden Jahren noch weiter ansteigt. So kann nach Berechnungen einer internationalen Studie mit einer weltweiten Erhöhung der Prävalenz um 60 - 107 % bis zum Jahr 2040 gerechnet werden [Gregory 2022]. Auch wenn diese Entwicklung sicherlich auch der erhöhten Lebenserwartung von Betroffenen – nicht zuletzt dank anhaltender Verbesserungen in der Versorgung – zuzuschreiben ist, zeichnet sich hierzulande auch in der Zahl der Neuerkrankungen seit Jahren keine Senkung ab. So hat sich die Inzidenz bei Kindern und Jugendlichen im Alter von 0 bis 17 Jahren mit geschätzten 29,2 pro 100 000 Personenjahren nach jüngsten Daten aus dem Jahr 2020 unter Einwirkung der COVID-19-Pandemie zuletzt sogar erhöht [Buchmann 2023].
Zusammenfassung
Der Typ-1-Diabetes kann bereits Jahre vor der klinischen Diagnose durch den Nachweis multipler Inselzellantikörper erkannt werden, auf deren Basis und je nach Glykämie-Status eine Einteilung in die präsymptomatischen Stadien 1 und 2 möglich ist. Eine Früherkennung im Rahmen wissenschaftlicher Studien geht mit deutlichen gesundheitlichen Vorteilen zum Zeitpunkt der Diagnosestellung und darüber hinaus einher. Mit dem monoklonalen Anti-CD3-Antikörper Teplizumab steht nun erstmals in den USA und möglicherweise bald auch in Europa ein Arzneimittel zur Verfügung, das die Zeit im Stadium 2 bis zur Diabetes-Manifestation nachweislich um mehr als 2,5 Jahre verzögern kann. Diese Aussicht verstärkt die Diskussion nach einer Ausweitung von Screening-Maßnahmen zur Früherkennung in der Bevölkerung, erfordert jedoch eine ethische Abwägung und eine klare gesundheitspolitische Rahmensetzung auch hinsichtlich der medizinischen und psychologischen Betreuung Betroffener.
Schlüsselwörter
Typ-1-Diabetes, Früherkennung, Autoantikörper, Teplizumab, Immuntherapie
Early Detection at Different Stages of Type 1 Diabetes
Summary
Type 1 diabetes can be identified years before clinical diagnosis based on the detection of multiple islet autoantibodies. Based on this and depending on glycaemic status, a distinction is made between the pre-symptomatic stages 1 and 2. In scientific studies, early detection was associated with significant health benefits at the time of diagnosis and beyond. Teplizumab, an anti-CD3 monoclonal antibody, is the first drug available in the US that has been shown to delay the onset of diabetes in stage 2 by more than 2.5 years. It may soon be available in Europe. This perspective is fuelling the debate about extending population-based screening, but it also requires ethical considerations and a clear public health framework for the medical and psychological care of those affected.
Keywords
Type 1 Diabetes, Screening, Autoantibodies, Teplizumab, Immunotherapy
Hintergrund
Eine der schwerwiegendsten akuten Komplikationen des Typ-1-Diabetes ist die diabetische Ketoazidose (DKA) – ein potenziell lebensbedrohlicher Zustand, bei dem es neben Elektrolytverschiebungen und neurologischen Ausfällen in seltenen Fällen auch zur Entwicklung eines Hirnödems kommen kann [Nyenwe 2016]. Das Auftreten einer DKA ist mittel- und langfristig mit einem ungünstigeren Krankheitsverlauf und schlechterer glykämischer Kontrolle sowie kognitiven Beeinträchtigungen assoziiert [Duca 2019, Ghetti 2020, Duca 2017] – und erhöht das Risiko für eine erneute DKA-Episode auch noch vier Jahre später [Hammersen 2021]. Die DKA-Rate bei der Typ-1-Diabetes-Manifestation bei Betroffenen unter 18 Jahren lag in den Jahren 2000 - 2019 mit zuletzt steigender Tendenz bei etwa 20 % [Segerer 2021]. Darüber hinaus ist die Diabetes-Diagnose neben einer hohen psychischen Belastung nach wie vor mit einem signifikant erhöhten Risiko für mikro- und makrovaskuläre Komplikationen, insbesondere kardiovaskulärer Natur, verbunden. So verringert sich die Lebenserwartung bei Zehnjährigen nach Typ-1-Diabetes-Diagnosestellung im Durchschnitt um 11 Jahre [Gregory 2022]. Eine frühe Manifestation des Diabetes (Alter <10 Jahre) ist hierbei mit einem deutlich höheren Verlust an Lebensjahren assoziiert als eine spätere Manifestation (Diagnose im Alter von 26 - 30 Jahren) [Rawshani 2018].
Die klinische Diagnose des Typ-1-Diabetes beruht auf dem Auftreten von Symptomen wie Polyurie, Polydipsie, Müdigkeit und Gewichtsabnahme sowie einer Hyperglykämie (Blutzuckerwert > 200 mg/dl = 11,1 mmol/l) [Deutsche Diabetes Gesellschaft e.V. (DDG) 2023]. Zu diesem Zeitpunkt ist nach Schätzungen jedoch bereits 80 % der β-Zell-Funktion verlorengegangen [Dayan 2021]. Dabei können Autoantikörper gegen β-Zell-Antigene bereits Monate oder Jahre vor einer klinischen Manifestation nachgewiesen werden und als zuverlässiger Marker für ein erhöhtes Erkrankungsrisiko dienen. Aus wissenschaftlichen Studien ist bekannt, dass die Früherkennung von Typ-1-Diabetes im präklinischen Stadium mit einer signifikant geringeren DKA-Rate [Elding Larsson 2011; Elding Larsson 2014] und niedrigeren HbA1c-Werten in den ersten Jahren nach klinischer Diagnosestellung assoziiert ist [Lundgren 2019; Hummel 2023]. Aus diesem Grund beginnt eine intensive Diskussion darüber, ein Screening zur Früherkennung eines Typ-1-Diabetes in die Regelversorgung einzubeziehen. Neuen Schub hat die Debatte nun durch die Zulassung des monoklonalen Anti-CD3-Antikörpers Teplizumab in den USA erhalten, durch die erstmals auch ein wirksames Mittel zur Verfügung steht, um eine klinische Manifestation von Typ-1-Diabetes bei Personen mit sehr hohem Risiko nachweislich zu verzögern.
βAA: Autoantikörper gegen β-Zell-Antigene
DKA: Diabetische Ketoazidose
FPIS: Erstphasen-Insulin-Antwort (engl. first-phase insulin secretion)
GADA: Glutamatdekarboxylase-Antikörper
HbA1c: glykiertes Hämoglobin
HLA: humanes Leukozytenantigen
IAA: Insulin-Autoantikörper
IA2A: Antikörper gegen Tyrosinphosphatase IA-2
ICA: zytoplasmatische Inselzell-Antikörper
IgG: Immunglobulin G
oGTT: oraler Glukose-Toleranztest
UE: Unerwünschte Ereignisse
ZnT8A: Antikörper gegen Zink-Transporter 8
Risikofaktoren und Marker
Bei der Entstehung des Typ-1-Diabetes sind sowohl genetische als auch umweltbedingte Faktoren beteiligt. Nach heutigem Verständnis nehmen dabei nicht nur das Immunsystem, sondern auch die β-Zellen über eine vermehrte Oberflächenexpression von β-Zell-spezifischen Autoantigenen eine aktive Rolle bei der Typ-1-Diabetes-Entwicklung ein [Roep 2021]. Wie diese Prozesse ausgelöst werden, und welche Bedeutung genetische und umweltbedingte Einflüsse wie perinatale Stressfaktoren, virale Infektionen oder die Ernährung als Auslöser spielen, ist noch vielfach ungeklärt. Einer der wichtigsten Risikomarker für die Entstehung eines Typ-1-Diabetes sind Autoantikörper gegen β-Zell-Antigene (βAA), deren Nachweis meist die Grundlage für eine Typ-1-Diabetes-Früherkennung bildet. Nach Daten der TEDDY-Studie können diese Antikörper bereits sehr früh, mit einem Peak bei einem Lebensalter von einem Jahr, auftreten [Krischer 2015]. Hierbei handelt es sich häufig um gegen Insulin gerichtete Antikörper (IAA), während bei Kindern, bei denen die Serokonversion zur βAA-Positivität zu einem späteren Zeitpunkt erfolgt, Glutamatdecarboxylase-Antikörper (GADA) häufig zuerst auftreten. Weitere wichtige βAA sind Antikörper gegen die Tyrosinphosphatase IA-2 (IA2A) sowie den Zink-Transporter 8 (ZnT8A) oder zytoplasmatische Inselzell-Antikörper (ICA). IA2A scheinen ein besonders hohes Risiko für eine Progression zu Typ-1-Diabetes innerhalb von 10 Jahren bei Kindern anzuzeigen [Ziegler 2013]. 80 % aller Kinder und Jugendlichen mit Typ-1-Diabetes entwickeln diabetes-assoziierte Antikörper bereits vor dem 5. Lebensjahr [Ziegler 2012]. Die Nachverfolgung einer Geburtskohorte von 13 000 Kindern zeigte, dass bei allen Kindern 20 Jahre nach erstmaligem Nachweis multipler βAA ein klinischer Typ-1-Diabetes aufgetreten ist [Ziegler 2023]. Es wird jedoch angenommen, dass βAA eher als Folge und weniger als Mediatoren der Zerstörung von β-Zellen durch T-Zellen entstehen [Kawasaki 2023].
Während zu Beginn dieses Prozesses noch keine klinischen Symptome festgestellt werden können, äußert sich die zunehmende Zerstörung der β-Zellen häufig bereits zum Zeitpunkt der Serokonversion durch einen Verlust der frühen C-Peptid-Sekretion oder präsymptomatische Veränderungen der Erstphasen-Insulin-Antwort (engl. first-phase insulin secretion, FPIS) [Sims 2020]. So war bereits bei Studieneintritt, der durchschnittlich 6,5 Jahre vor der Diagnose lag, im TrialNet Pathway to Prevention (PTP)-Kohortenprogramm bei Verwandten von Typ-1-Diabetes-Betroffenen mit βAA-Nachweis die frühe C-Peptid-Antwort verglichen mit βAA-negativen Verwandten um 40 % reduziert [Evans-Molina 2018]. In der finnischen Diabetes Prediction and Prevention (DIPP)-Studie zeigte sich bei 42 % von 52 Kindern mit neu identifizierten βAA und Hochrisiko-HLA-Allelen eine FPIS unterhalb des 5. Perzentils, die in dieser Gruppe somit bereits 4 - 6 Jahre vor der Typ-1-Diabetes-Diagnose signifikant verändert war [Koskinen 2020]. Ein Fortschreiten der β-Zell-Dysfunktion äußert sich schließlich in einer graduellen Verschlechterung der Glykämie und einer signifikanten Senkung der C-Peptid-Sekretion etwa ab 2 Jahre vor Typ-1-Diabetes-Manifestation, mit der diese Veränderungen schließlich funktionelle Einschränkungen hervorrufen [Sims 2020].
Drei Stadien des Typ-1-Diabetes
Auf Grundlage dieser Erkenntnisse werden drei Stadien des Typ-1-Diabetes unterschieden (Abbildung 1): Stadium 1 ist definiert durch das Vorhandensein von zwei oder mehr Autoantikörpern und geht für die Betroffenen mit einem Risiko von 44 beziehungsweise 70 % einher, innerhalb von fünf oder zehn Jahren einen klinischen Typ-1-Diabetes zu entwickeln. Bei Stadium 2 sind zwei oder mehr Autoantikörper und eine β-Zell-Dysfunktion infolge der β-Zell-Schädigung nachweisbar, wobei das 5-Jahres-Risiko einer Typ-1-Diabetes-Manifestation bei 75 % liegt. Stadium 3 entspricht schließlich dem klinischen Typ-1-Diabetes [Insel 2015]. Der individuelle zeitliche Verlauf kann jedoch sehr unterschiedlich sein und sich von Wochen bis zu fast 20 Jahren hinziehen [Ziegler 2013]. Die Stadien werden in der neuesten ICD-10 Kodierung in den USA ab Oktober 2024 als eigenständige Entitäten anerkannt: E10.A0 – Typ 1 Diabetes mellitus, präsymptomatisch, unspezifiziert; E10.A1 – Typ 1 Diabetes mellitus, präsymptomatisch, Stadium 1 und E10.A2 – Typ 1 Diabetes mellitus, präsymptomatisch, Stadium 2 [Centers for Disease Control and Prevention 2023].
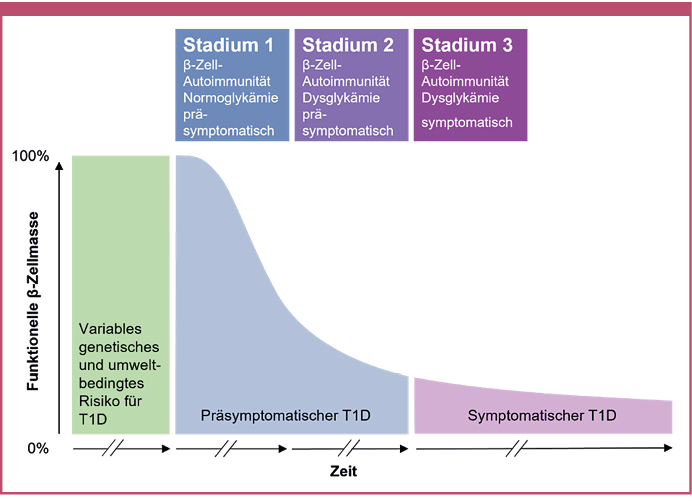 Abbildung 1: Stadien des Typ-1-Diabetes. Modifiziert nach [Insel 2015] unter den Bedingungen der Creative Commons CC BY Lizenz.
Abbildung 1: Stadien des Typ-1-Diabetes. Modifiziert nach [Insel 2015] unter den Bedingungen der Creative Commons CC BY Lizenz.
Genetische Risikofaktoren
Ein weiterer wichtiger Risikofaktor ist eine familiäre Vorbelastung, welche mit einem etwa 15-fach erhöhten Risiko für die Entstehung eines Typ-1-Diabetes einhergeht [Besser 2022] – auch wenn bis zu 90 % der neu diagnostizierten Fälle keine positive Familienanamnese aufweisen [Turtinen 2019]. Insgesamt wurden in genetischen Studien bisher 78 Risikoloci im humanen Genom identifiziert, die mit einem signifikant erhöhten Typ-1-Diabetes-Risiko assoziiert sind und insbesondere die T-Zellfunktion beeinflussen [Robertson 2021]. Eine genetische Prädisposition steht vor allem im Zusammenhang mit Hochrisikovarianten der humanen Leukozyten-Antigen (HLA)-Haplotypen, insbesondere DR3-DQ2 und DR4-DQ8, die in bis zu 90 % aller Typ-1-Diabetes-Patienten nachweisbar sind und ca. 40 - 50 % der gesamten Typ-1-Diabetes-Erblichkeit ausmachen [Herold 2024]. So wurde in der DIPP-Studie der Höchstrisiko-DR/DQ-Genotyp in 21,6 % der Patienten und nur 2,0 % der Kontrollen detektiert, sodass Träger dieses Genotyps eine 13,2-fach höheren Chance für eine Typ-1-Diabetes-Erkrankung aufwiesen [Ilonen 2016]. Offenbar beeinflusst die DR/DQ-Prädisposition jedoch vor allem das Risiko für eine β-Zell-Autoimmunität und weniger das spätere Stadium des Fortschreitens von der βAA-Positivität zur klinischen Typ-1-Diabetes-Manifestation [Koskinen 2018]. Neugeborene, deren Eltern oder Geschwister tatsächlich an Typ-1-Diabetes erkrankt sind, haben je nach HLA-Genotyp sogar ein bis zu 100-fach erhöhtes Risiko, selbst zu erkranken [Insel 2015]. Nichtsdestotrotz muss betont werden, dass die Mehrzahl der HLA-Risikoträger nie einen Typ-1-Diabetes entwickelt.
Risikoevaluierung und Programme zur Früherkennung
In Deutschland wird bisher nur im Rahmen von wissenschaftlichen Studien die Möglichkeit zur Früherkennung von Typ-1-Diabetes bei Kindern und Jugendlichen angeboten. Diese Studien basieren auf Tests gegen Autoantikörper und/oder dem Nachweis genetischer Risikovarianten, insbesondere DR3-DQ2 und DR4-DQ8. Da viele der Risikovarianten allein nur einen geringen Effekt auf die Erkrankungswahrscheinlichkeit haben, wird dabei häufig ein genetischer Risikoscore berechnet, der die Anzahl verschiedener genetischer Hochrisikovarianten gewichtet berücksichtigt. Diese Tests können bereits bei Geburt durchgeführt werden, während Antikörper erst später zutage treten. Das Screening auf Autoantikörper basierte lange Zeit auf technisch aufwändigen radioimmunologischen Messungen, wird jedoch heutzutage meist durch neuere Ansätze wie ELISA oder PCR-Assays ersetzt. Diese neuen Testverfahren reduzieren die erforderliche Probenmenge auf ein Minimum und können auch außerhalb von Testzentren im ambulanten Bereich oder zuhause aus Kapillarblut entnommen werden, sodass sie für eine breite pädiatrische Anwendung geeignet sind [Tandel 2024]. Zur Bestätigung positiver Ergebnisse werden jedoch im Rahmen wissenschaftlicher Studien nach wie vor Radioimmunoassays als Goldstandard herangezogen [Ziegler 2020].
Eine der wichtigsten laufenden Studien zur Typ-1-Diabetes-Früherkennung in Deutschland ist die Fr1da-Studie, die in Zentren in Bayern, Niedersachsen, Hamburg und Sachsen bei Kindern im Alter zwischen 2 und 10 Jahren oder deutschlandweit bei Kindern und Jugendlichen zwischen 1 und 21 Jahren, die einen Verwandten mit Typ-1-Diabetes haben, durchgeführt wird. Die Studie beruht auf dem Nachweis von βAA im Kapillarblut und ermöglicht bei Positivität den Einschluss in ein weiterführendes Schulungsprogramm mit weiteren metabolischen Untersuchungen (www.typ1diabetes-frueherkennung.de).
Des Weiteren läuft momentan auch die Freder1k-Studie in Bayern, Niedersachsen, Sachsen und Thüringen, die dort im Rahmen des regulären Neugeborenen-Screenings durchgeführt werden kann und auf dem genetischen Risiko eines Typ-1-Diabetes beruht (www.gppad.org/de/frueherkennung/). Die Studie wird für Kinder mit erstgradiger Verwandtschaft zu einem Typ-1-Diabetes-Erkrankten auch deutschlandweit durchgeführt. Zusammen mit laufenden Programmen in anderen europäischen Ländern entsteht hierdurch die Datenbasis für die Globale Plattform zur Prävention des Autoimmunen Diabetes (GPPAD). Säuglinge mit positivem Screening-Ergebnis können anschießend in laufende Interventionsstudien der GPPAD-Initiative eingeschlossen werden (www.gppad.org/de).
Ein großes internationales Projekt ist auch TrialNet, der Zusammenschluss weltweit führender Institutionen im Bereich der Typ-1-Diabetes-Forschung. In diesem Rahmen wurden zahlreiche klinische Studien durchgeführt, die eine der wichtigsten Grundlagen auf diesem Gebiet bilden [Battaglia 2017]. INNODIA ist ebenfalls ein europäisches Netzwerk für klinische Typ-1-Diabetes-Forschung (www.innodia.eu/de), in deren Rahmen aktuell die Ver-A-T1D-Studie mit Verapamil bei kürzlich diagnostiziertem Typ-1-Diabetes in Personen zwischen 18 und 45 Jahren durchgeführt wird (siehe auch Kapitel Ausblick: Strategien zur Prävention). EDENT1FI ist ebenfalls eine europäische Initiative über 12 Länder, die sich um die Entwicklung und Implementierung von populationsweiten βAA-Screenings bei Kindern einsetzt (www.edent1fi.eu/).
Früherkennung bietet wichtige gesundheitliche Vorteile
Basierend auf Ergebnissen der internationalen TEDDY-Studie, die auch in Deutschland durchgeführt wurde und Kinder mit einem Risiko-DR/DQ-Genotyp einschloss, wiesen Studienteilnehmer bei Typ-1-Diabetes-Diagnosestellung signifikant weniger Symptome (58 % vs. 98 %), eine geringere DKA-Rate (0 % vs. 14 %) sowie einen deutlich niedrigeren HbA1c-Wert (6.8 % vs. 10.5 %) im Vergleich zu Kindern auf, die außerhalb dieses Programms diagnostiziert wurden [Steck 2017]. Ähnliche Ergebnisse zeigten auch Kinder mit einer präklinischen Typ-1-Diabetes-Diagnose basierend auf βAA-Positivität in der Fr1da-Studie (DKA-Rate 2,5 % und medianer HbA1c-Wert 6,8 vs. 10,5 % [Hummel 2023]) sowie der BABYDIAB-Studie/Münchner Familienstudie (DKA-Prävalenz 3,3 vs. 29,1 % und HbA1c-Wert 8,6 vs. 11 % [Winkler 2012]) jeweils im Vergleich zu einer separaten Kontrollgruppe ohne Früherkennung bei Diabetes-Manifestation. Diese Vorteile könnten einen langfristigen Effekt haben: So war bei Kindern, die präsymptomatisch in die schwedische DiPiS-Studie eingeschlossen wurden, der HbA1c-Wert auch 5 Jahre nach Typ-1-Diabetes-Manifestation noch signifikant niedriger als in einer Kontrollgruppe ohne Früherkennung [Lundgren 2019]. Auch die C-Peptid-Spiegel, die als Parameter für die verbleibende β-Zell-Funktion dienen und mit einer besseren Langzeit-Diagnose verbunden sind, waren bei den TEDDY-Studienteilnehmern mindestens über einen Zeitraum von 12 Monaten nach Diagnose höher [Steck 2017]. Zugleich wurde berichtet, dass diese Kinder eine höhere diabetes-bezogene Lebensqualität nach Diabetes-Manifestation aufwiesen und die Diagnose mit weniger Stress für die Eltern verbunden war als bei Kindern, bei denen Typ-1-Diabetes ohne vorherige Aufklärung diagnostiziert wurde [Smith 2018]. Tatsächlich erhöhte laut einer Befragung von Eltern, deren Kinder im Rahmen des DIPP-Studienprogramms an der interventionellen Insulin-Präventionsstudie [Näntö-Salonen 2008] teilnahmen, die Benachrichtigung über eine βAA-Positivität – im Gegensatz zu einer tatsächlichen Diabetes-Diagnose – den Stress-Index der Eltern betroffener Kinder nicht signifikant [Goldstein 2009].
Ausblick: Strategien zur Prävention
Früherkennung ist ein Wegbereiter für eine frühzeitige therapeutische Intervention mit dem langfristigen Ziel der Prävention von Typ-1-Diabetes. Bereits seit mehreren Jahren werden dazu verschiedene Wirkstoffe auf ihr Potenzial zur Verzögerung oder Verhinderung der Diabetes-Manifestation untersucht. Seit November 2022 steht in den USA nun erstmals ein Wirkstoff mit dieser Indikation zur Verfügung: Teplizumab, ein monoklonaler Antikörper, der gegen CD3 auf T-Zellen gerichtet ist und zur Verzögerung des Auftretens eines manifesten Typ-1-Diabetes (Stadium 3) bei Erwachsenen und pädiatrischen Patienten im Alter von 8 Jahren und älter mit Typ-1-Diabetes im Stadium 2 (positiv auf mindestens 2 βAA und glykämische Auffälligkeiten) zugelassen ist. Die Wirkung von Teplizumab beruht wahrscheinlich auf einer partialagonistischen Aktivierung des T-Zellrezeptors auf der T-Zelloberfläche. Es wird angenommen, dass dies zu einer teilweisen oder vorübergehenden Erschöpfung und letztlich verringerten Autoreaktivität der CD8+-Effektor-T-Zellen führt, die eine zentrale Rolle bei der Zerstörung der β-Zellen spielen [Long 2016].
Teplizumab: Klinische Studie mit Betroffenen im Stadium 2
Die Zulassung von Teplizumab in den USA beruht auf der TN-10-Studie. Darin wurden Personen im Alter von 8 bis 45 Jahren mit einem Verwandten mit Typ-1-Diabetes, einer oGTT-bestätigten Glukoseintoleranz und mindestens zwei bestätigten βAA (Stadium 2) eingeschlossen. Der primäre Endpunkt war die Zeit von der Randomisierung bis zur klinischen Typ-1-Diabetes-Diagnose, basierend auf regelmäßig durchgeführten oGTT. Eine einmalige 14-tägige Teplizumabgabe mit ansteigender Dosis verlängerte die Zeit bis zur Diagnose (Stadium 3) gegen Placebo im Median um 2 Jahre (Hazard Ratio 0,41). Die stärksten Effekte waren hierbei im ersten Jahr zu beobachten, wo nur 7 % der Probanden der Teplizumab-Gruppe im Gegensatz zu 44 % in der Placebo-Gruppe mit Typ-1-Diabetes diagnostiziert wurden. Interessanterweise war die Abwesenheit von HLA-DR3 und ZnT8A, aber das Vorhandensein von HLA-DR4 sowie niedrige C-Peptid-Antworten nach oGTT mit einer höheren Ansprechrate von Teplizumab verbunden [Herold 2019].
In einer erweiterten Follow-up-Analyse waren nach etwa 2,5 Jahren noch 50 % der mit Teplizumab behandelten Teilnehmer ohne Typ-1-Diabetes-Diagnose, verglichen mit nur 22 % in der Placebogruppe. Desweiteren war Teplizumab im Vergleich zu Placebo mit einer signifikant besseren β-Zellfunktion, gemessen an der C-Peptid-Sekretion, assoziiert und verzögerte somit die Notwendigkeit einer Insulinbehandlung im Median um 2,7 Jahre [Sims 2021]. In einer nachfolgenden integrierten Analyse mehrerer Studien sowie einer Meta-Analyse von acht randomisierten kontrollierten Studien mit 866 Patienten wurde bestätigt, dass die Gabe von Teplizumab nach klinischer Manifestation (Stadium 3) zu einer geringeren Abnahme der β-Zellfunktion und Insulinproduktion führt und nach 12 und 24 Monaten mit einem geringeren exogenen Insulinverbrauch als Placebo verbunden ist. Jedoch wurde zu keinem Zeitpunkt eine signifikante Wirkung von Teplizumab auf den HbA1c-Wert beobachtet [Nourelden 2021, Herold 2023].
Unerwünschte Ereignisse (UE) während der Teplizumab-Verabreichung umfassten eine Lymphozytopenie und eine milde Form des Zytokin-Freisetzungssyndroms, was wahrscheinlich auf die Teplizumab-Wirkung auf T-Zellen zurückzuführen ist. Diese Ereignisse waren in den meisten Fällen milden oder moderaten Ausmaßes, vorübergehend und behandelbar [Herold 2023]. Teplizumab führte nicht zu einer dauerhaften Immunsuppression [Ramos 2023]. Allerdings gibt es noch keine langfristigen Nachuntersuchungen. Strukturierte Daten aus den verfügbaren Studien (Protégé, Encore2, Delay, AbATE, TN-10) liegen für 791 Probanden mit Teplizumab und 245 mit Placebo behandelten Teilnehmern vor und ergaben bislang keine Hinweise auf negative Langzeitfolgen.
Teplizumab: Klinische Studien mit Betroffenen im Stadium 3
Ob Teplizumab auch nach einer Typ-1-Diabetes-Diagnose im frühen Stadium 3 den Krankheitsverlauf positiv beeinflussen kann, wurde in der kürzlich veröffentlichten PROTECT-Studie bei Kindern und Jugendlichen im Alter von 8 bis 17 Jahren untersucht. Die Studienteilnehmer wurden durchschnittlich 5,3 Wochen nach Typ-1-Diabetes-Diagnose eingeschlossen und wiesen mindestens einen βAA sowie einen Peak-C-Peptid-Wert von ≥0,2 pmol/ml auf. Anschließend erhielten die Teilnehmer randomisiert im Verhältnis 2:1 Teplizumab oder Placebo in zwei 12-tägigen Behandlungen im Abstand von 26 Wochen. Tatsächlich waren nach 78 Wochen die stimulierten C-Peptid-Level im Vergleich zu Baseline in der Teplizumab-Gruppe signifikant höher (primärer Endpunkt). Allerdings wurden die sekundären Endpunkte wie HbA1c-Wert und Zeit im Glukose-Zielbereich nicht erreicht [Ramos 2023].
Weitere immunmodulatorische Ansätze im Stadium 3
Neben Teplizumab werden aktuell auch zahlreiche weitere immunmodulatorische Therapien im Rahmen klinischer Studien auf ihre Wirksamkeit zur Verzögerung der β-Zellzerstörung untersucht, insbesondere bei Personen im frühen Stadium 3. Ein möglichst langfristiger Erhalt der β-Zellfunktion wird mit Vorteilen hinsichtlich der glykämischen Einstellung, einer Senkung der notwendigen exogenen Insulindosis und einer geringeren Hypoglykämie-Rate in Verbindung gebracht [Gubitosi-Klug 2021]. Die Therapien mit den bisher vielversprechendsten Studienergebnissen sind in Tabelle 1 zusammengefasst.
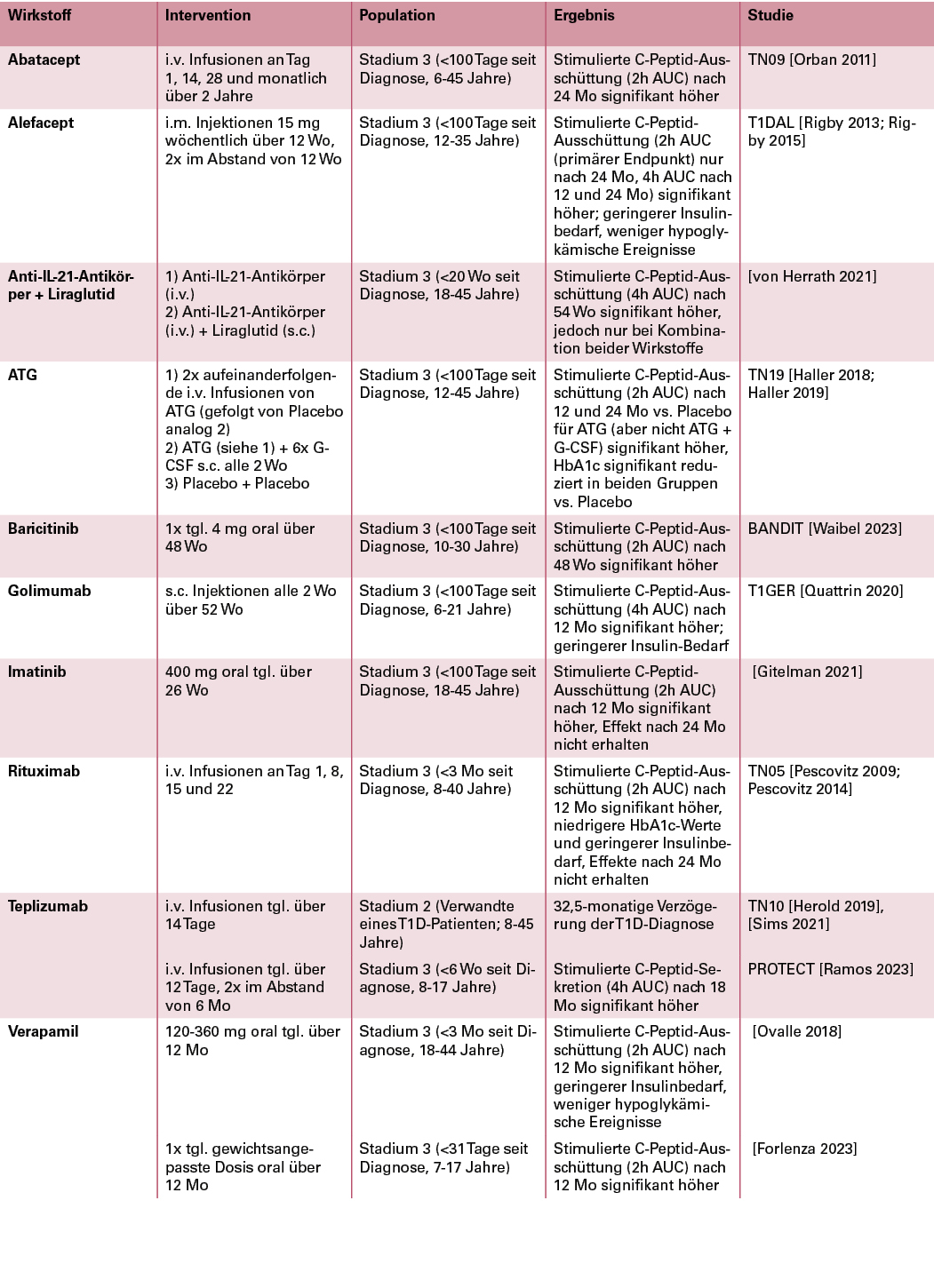 Tabelle 1: Pharmakologische Ansätze zur Verbesserung der β-Zellfunktion im Typ-1-Diabetes-Stadium 2 oder 3 mit positiven Ergebnissen in klinischen Studien (alphabetisch sortiert).
Tabelle 1: Pharmakologische Ansätze zur Verbesserung der β-Zellfunktion im Typ-1-Diabetes-Stadium 2 oder 3 mit positiven Ergebnissen in klinischen Studien (alphabetisch sortiert).
Abkürzungen: ATG, Anti-Thymozyten-Globulin; AUC, area under the curve; G-CSF, Granulozyten-Kolonie-stimulierender Faktor; HbA1c, glykiertes Hämoglobin; i.m., intramuskulär; i.v., intravenös; Mo, Monate; s.c., subkutan; tgl., täglich; Wo, Wochen.
Viele der untersuchten Immunmodulatoren richten sich gegen T-Zellen. Ein entsprechender Kandidat ist Abatacept, das als Fusionsprotein aus der extrazellulären Domäne des Proteins CTLA4 und einer modifizierten Fc-Region des humanen Immunglobulin G (IgG) die Aktivierung von T-Zellen verhindert. Es wird zur Behandlung der rheumatoiden Arthritis eingesetzt. In der TN09-Studie in Personen nach kürzlicher Typ-1-Diabetes-Diagnose wurde Abatacept auf eine mögliche Wirksamkeit hinsichtlich des Erhalts der β-Zellfunktion untersucht. Nach einer zweijährigen Anwendungszeit war dabei die C-Peptid-Sekretion nach einer Mischmahlzeit in der Verum-Gruppe um 59 % höher als unter Placebo, mit einer geschätzten Verzögerung der C-Peptid-Senkung um 9,6 Monate. Es wurden nur wenige infusionsbedingte UE und keine Zunahme von Infektionen oder Neutropenien berichtet [Orban 2011]. Die Wirkung von Abatacept scheint jedoch erst im späteren Verlauf der Typ-1-Diabetes-Entstehung zum Tragen zu kommen. So konnte in einer kürzlich veröffentlichten Phase-II-Studie (TN18) bei 6- bis 45-jährigen Probanden im Stadium 1 keine Verzögerung des Auftretens abnormaler Ergebnisse im Glukose-Toleranztest oder einer Typ-1-Diabetes-Diagnose nachgewiesen werden [Russell 2023].
Ein weiterer Ansatz, der in mehreren Studien auf potenzielle Effekte zum Erhalt der β-Zellfunktion verfolgt wurde, ist die T-Zell-Depletierung durch Anti-Thymozyten-Globulin (ATG). Obwohl in einer vorhergehenden Untersuchung (START-Studie) keine Veränderung der C-Peptid-Sekretion berichtet wurde [Gitelman 2016], war die ATG-Gabe in der TN19-Studie nach einem und zwei Jahren mit einer signifikant höheren C-Peptid-Sekretion sowie signifikant niedrigeren HbA1c-Werten als Placebo in Probanden mit kürzlicher Typ-1-Diabetes-Diagnose verbunden [Haller 2018; Haller 2019]. Trotz einer deutlich geringeren Dosis in diesen Studien im Vergleich zur Anwendung von ATG bei Transplantat-Abstoßungsreaktionen kam es signifikant häufiger zu Fällen einer Serumkrankheit oder eines Zytokin-Freisetzungssyndroms. Es wurden jedoch keine schweren UE oder schwere Infektionen infolge der Behandlung berichtet.
Auch das LFA3-IgG-Fusionsprotein Alefacept, das die Proliferation und Aktivierung von T-Zellen blockiert, verringerte in der T1DAL-Studie bei Probanden mit einer Typ-1-Diabetes-Diagnose, die höchstens 100 Tage vorher erfolgt sein durfte, den Verlust von stimulierten C-Peptid-Reaktionen – im definierten primären Endpunkt jedoch nur in der Folgestudie nach 24 Monaten [Rigby 2013, Rigby 2015]. Es konnte in beiden Studien eine signifikante Verbesserung in sekundären Endpunkten wie dem täglichen Insulinbedarf und der Hypoglykämierate (50 %ige Senkung nach 2 Jahren) gezeigt werden. So bleibt abzuwarten, ob diese Ergebnisse auch in einer größer angelegten Studie bestätigt werden können. Der Wirkstoff wurde ursprünglich zur Behandlung der Psoriasis entwickelt, ist hierzulande jedoch nicht auf dem Markt.
Die Wirksamkeit von Golimumab, einem gegen Tumornekrosefaktor α (TNFα) gerichteten monoklonalen Antikörper zur Behandlung verschiedener chronisch-entzündlicher Erkrankungen, wurde ebenfalls in jungen Probanden mit neu diagnostiziertem Typ-1-Diabetes untersucht. Tatsächlich konnte in dieser Studie Golimumab die stimulierte C-Peptid-Sekretion nach einem Jahr im Vergleich zu Placebo deutlich erhöhen. Es war zudem mit einer geringeren Insulindosis, jedoch auch einer erhöhten Hypoglykämie-Rate assoziiert [Quattrin 2020].
Mit Rituximab als Anti-CD20-Antikörper, der bislang zur Therapie von Autoimmunerkrankungen und malignen B-Zell-Erkrankungen eingesetzt wird, wird auch ein B-Zell-gerichteter Ansatz zur Verbesserung der β-Zellfunktion bei Personen mit neu diagnostiziertem Typ-1-Diabetes verfolgt. In der TN05-Studie konnte jedoch nur eine kurzfristige Verbesserung der stimulierten C-Peptid-Ausschüttung, des Insulinbedarfs sowie des HbA1c-Werts gegenüber Placebo gezeigt werden – weitere Studien bleiben abzuwarten [Pescovitz 2009, Pescovitz 2014].
Weitere untersuchte Wirkstoff-Kandidaten sind Baricitinib, ein Januskinase (JAK)-Inhibitor zur Behandlung autoimmuner Erkrankungen wie schwerer rheumatoider Arthritis oder atopischer Dermatitis, und Imatinib, ein Tyrosinkinaseinhibitor, der als Chemotherapeutikum Einsatz findet. Beide Wirkstoffe können oral verabreicht werden und erhöhten in Phase-II-Studien bei Personen im Stadium 3 nach kürzlicher Diagnosestellung die C-Peptid-Ausschüttung nach etwa einem Jahr signifikant. Die kurze Halbwertszeit von Baricitinib lässt vermuten, dass für längerfristige Effekte eine längere Einnahmedauer erforderlich ist; und auch bei Imatinib war der Effekt auf die C-Peptid-Werte nach einer täglichen Einnahme über ein halbes Jahr zwei Jahre später nicht mehr statistisch nachweisbar [Waibel 2023, Gitelman 2021].
Zudem wurde auch eine klinische Studie bei Erwachsenen mit neu diagnostiziertem Typ-1-Diabetes mit einem Anti-IL-21-Antikörper und dem GLP-1-Rezeptoragonisten Liraglutid durchgeführt [von Herrath 2021]. Die Kombination beider Wirkstoffe führte zu einem um 10 % geringeren Rückgang der stimulierten C-Peptid-Sekretion nach 54 Wochen im Vergleich zu Placebo. Es bleibt abzuwarten, ob dieser Ansatz in Folgestudien weiter verfolgt werden wird.
Verapamil: Ungeahntes inselzellprotektives Potential?
Ein ganz anderer Weg zur Protektion der β-Zellfunktion bei Typ-1-Diabetes wird mit Verapamil beschritten. Aus präklinischen Studien ist bekannt, dass Calciumkanal-Blocker die diabetesbedingte Überexpression des Proteins TXNIP auf β-Zellen hemmen. TXNIP unterdrückt den Abbau schädlicher reaktiver Sauerstoffspezies und trägt so zur Zerstörung der β-Zellen bei [Xu 2012]. In der Tat war in einer klinischen Studie bei Erwachsenen mit kürzlich diagnostiziertem Typ-1-Diabetes eine tägliche Verapamilgabe nach 12 Monaten mit einer um 35 % höheren C-Peptid-Sekretion nach einer definierten Mischmahlzeit im Vergleich zu Placebo assoziiert, woraus eine deutlich bessere β-Zellfunktion abgeleitet werden kann [Ovalle 2018]. Zudem sank der Bedarf an exogenem Insulin und die Anzahl der Hypoglykämie-Episoden.
Auch in einer nachfolgenden Studie bei Kindern und Jugendlichen ab 7 Jahren wurde berichtet, dass nach 12-wöchiger Verapamilgabe die C-Peptid-Sekretion im Vergleich zu Placebo nach einem Jahr um 30 % erhöht war, jedoch ohne einen Einfluss auf sekundäre Endpunkte wie den HbA1c-Wert und die Zeit im Glukose-Zielbereich zu zeigen [Forlenza 2023]. Verapamil war in beiden Studien gut verträglich und zeigte in der gewählten Dosierung keine signifikante Veränderung des Blutdrucks, und ist auch dank seiner oralen Bioverfügbarkeit ein sehr vielversprechender Ansatz. Weitere Erkenntnisse können mit den Ergebnissen der Ver-A-T1D-Studie erwartet werden (NCT04545151).
Ausblick auf andere Behandlungsansätze in verschiedenen Stadien des Typ-1-Diabetes
Darüber hinaus wurde auch eine Modulierung der T-Zell-Antwort durch die Verabreichung von Antigenen, wie GAD-alum im frühen Stadium 3 oder intranasalem, parenteralem oder oralem Insulin zur Prävention bei Personen mit einem hohen Risiko für eine Typ-1-Diabetes-Manifestation untersucht. GAD-alum war mit ersten positiven Effekten auf die C-Peptid-Ausschüttung assoziiert [Nowak 2022]; weiterführende Ergebnisse können im Rahmen der Phase 3 DIAGNODE-3-Studie erwartet werden (NCT05018585). Trotz sehr guter Verträglichkeit konnte mittels Insulin-Verabreichung im Frühstadium bislang hingegen keine signifikante Senkung der Typ-1-Diabetes-Inzidenz gezeigt werden [Diabetes Prevention Trial--Type 1 Diabetes Study Group 2002, Skyler 2005, Näntö-Salonen 2008, Krischer 2017] – sicherlich auch, da sich die Festlegung einer optimalen Dosierung als sehr herausfordernd erweist. Möglicherweise ist der Effekt auch vom IAA-Titer abhängig [Vehik 2011]; weitere Erkenntnisse dazu werden mit der aktuell laufenden Fr1da-Studie mit oral-verabreichtem Insulin erwartet (NCT02620072).
Die SINT1A-Studie untersucht in einem anderen Ansatz den Einsatz von Probiotika zur Prävention einer Typ-1-Diabetes-Manifestation (NCT04769037). Und nicht zuletzt werden auch Stammzelltherapien zur Primärprävention von Typ-1-Diabetes diskutiert. Dieser Ansatz, der auf der Transplantation funktionaler β-Zellen aus pluripotenten Stammzellen beruht, könnte der zentralen Rolle von β-Zellen in der Typ-1-Diabetes-Pathogenese besser gerecht werden als die oben diskutierten immunmodulierenden Wirkstoffe [Millman 2016; Nair 2019]. Dies muss jedoch erst in klinischen Studien untersucht werden.
Zusammenfassend ist festzustellen, dass viele der Ansätze zu einer Verzögerung der Typ-1-Diabetes-Manifestation sehr vielversprechend sind, jedoch bisher allesamt noch keine Zulassung für diese Indikation in Deutschland erhalten haben. Es bleibt abzuwarten, welche Erkenntnisse kommende Studien liefern und ob möglicherweise auch eine Kombination verschiedener Wirkstoffe, die individuell nach βAA oder individuellem genetischen Risiko abgestimmt sein könnten, synergistische Effekte ermöglicht [Linsley 2021].
Diskussion
Trotz einer sich stetig verbessernden therapeutischen Versorgungslage für Typ-1-Diabetes-Patienten in Deutschland werden die Rufe nach einem systematischen Screening des Typ-1-Diabetes-Risikos im Sinne einer Früherkennung immer lauter. Dies hängt zum einen mit den erheblichen gesundheitlichen Vorteilen der Früherkennung zusammen, die die Senkung der DKA-Inzidenz [Elding Larsson 2011, Elding Larsson 2014] und eine Verbesserung der glykämischen Einstellung in den ersten Jahren nach klinischer Diagnosestellung [Lundgren 2019, Hummel 2023] einschließen. Andererseits ebnet Früherkennung auch den Weg für präventive Maßnahmen. Die Zulassung von Teplizumab in den USA als erstes verfügbares Medikament, das das Auftreten klinischer Symptome bei Typ-1-Diabetes (Stadium 3) nachweislich verzögert, eröffnet eine völlig neue Dimension in der Typ-1-Diabetes-Therapie. Mit Hinblick auf die vielen vielversprechenden immunmodulatorischen Wirkstoffe in der Pipeline kann dies als ein erster Schritt in eine neue Ära verstanden werden.
Es bestehen jedoch noch viele offene Fragen [Ziegler und Karges 2023]. Da die Erkenntnisse aus Früherkennungsstudien bisher vor allem auf klar abgesteckten wissenschaftlichen Studien mit engmaschiger Aufklärung und Betreuung der betroffenen Patienten beziehungsweise der Familien beruhen, ist die landesweite Umsetzbarkeit und der klinische Nutzen in der Praxis bisher nicht klar absehbar. Da aus Gründen der vergleichsweise geringen Typ-1-Diabetes-Inzidenz in der Allgemeinbevölkerung in den meisten der zitierten Studien keine parallele Begleitung einer Kontrollgruppe umgesetzt werden konnte, könnte etwa auch die Aufklärung und Betreuung der Studienteilnehmer bereits zu einer Verbesserung der klinischen Parameter bei Diagnosestellung beigetragen haben und zu einer Überschätzung des tatsächlichen Nutzens der Früherkennung führen. So ist beispielsweise bekannt, dass die DKA-Inzidenz auch über Informationskampagnen signifikant gesenkt werden kann [Holder 2020, Cherubini 2021]. Möglicherweise könnten Erkenntnisse aus Italien, wo durch einen kürzlich vorgenommenen Gesetzesbeschluss ein flächendeckendes Typ-1-Diabetes-Screening bei Kindern und Jugendlichen bereits in der Regelversorgung verankert ist, zu einem besseren Verständnis dieses Zusammenhangs beitragen [Bosi 2024].
Auch ist bisher nicht klar, welcher Zeitpunkt und welche Parameter (genetisches Risiko, Antikörper) idealerweise für das Screening herangezogen werden sollen [Besser 2022]. So gibt es verschiedene Haltungen dazu, ob ein Screening der generellen Bevölkerung oder nur von Hochrisikogruppen durchgeführt werden soll (etwa Verwandte von Typ-1-Diabetes-Betroffenen) [Sims 2022]. Eine genetische Untersuchung bei Neugeborenen kann zwar ein erhöhtes Risiko detektieren, jedoch weder voraussagen ob oder wann eine Diabetes-Manifestation auftritt, noch diejenigen, bei denen kein genetisches Risiko detektiert wird, von der Möglichkeit einer Erkrankung ausschließen. Aufgrund der hohen Variabilität des Typ-1-Diabetes-Verlaufs ist es auch schwierig festzulegen, welcher Zeitpunkt für ein breites Screening auf βAA-Antikörper optimal ist und welche Antikörper dafür herangezogen werden sollten. Möglicherweise können zwei Tests im Alter von 2 und 6 Jahren, gegebenenfalls kombiniert mit einem genetischen Screening bei Geburt, zu der höchstmöglichen Vorhersagewahrscheinlichkeit bei geringstmöglichem Aufwand führen [Ziegler 2020, Anand 2021, Dayan 2021]. Zum anderen muss auch festgelegt werden, wie mit den jeweiligen Ergebnissen umgegangen wird. So muss klar definiert sein, welche Grenzwerte für ein erhöhtes Risiko gelten um eine notwendige Nachsorge einzuleiten, und in welchem Umfang und welcher Frequenz diese erfolgen soll [Hendriks 2024]. Dies lässt sich aus klinischen Studien, die häufig aufwendige und engmaschige Begleituntersuchungen mit dem Ziel der wissenschaftlichen Datensammlung heranziehen, nicht ohne weiteres nutzeneffizient auf ein populationsbasiertes Screening übertragen [Besser 2022].
Ethische Abwägung
Darüber hinaus müssen jedoch auch ethische Aspekte berücksichtigt werden. Ein prädiktiver Antikörpertest kann aus einem klinisch gesunden Kind einen Patienten machen, ohne dass zum jetzigen Zeitpunkt eine therapeutische Intervention möglich ist – oder gerade auch durch die in absehbarer Zukunft mögliche Therapie eine Krankheitswahrnehmung erzeugt wird [Ziegler und Karges 2023]. Vor diesem Hintergrund sollte auch bedacht werden, dass die Nutzen-Risiko-Bewertung immunmodulierender Arzneimittel wegen der noch nicht absehbaren mittel- und langfristigen Folgen aktuell nur begrenzt möglich ist, aufgrund der vorgesehenen Behandlung klinisch gesunder Kinder jedoch besonders kritisch bedacht werden sollte. Es darf auch nicht übersehen werden, dass durch das Screening eine erhebliche psychologische Last auf Familien mit positiven Befunden gelegt wird, die häufig mit Stressreaktionen und Ängsten verbunden ist [Johnson 2017, Melin 2020]. Da der Zeitverlauf bis zu einer tatsächlichen Diagnose individuell sehr variabel ist, müssen Familien betroffener Kinder gegebenenfalls über Jahre mit dieser Last leben, auch wenn der psychische Stress der Eltern einige Monate nach dem positiven Befund häufig wieder deutlich abfällt [Ziegler 2020]. Demgegenüber bietet eine frühe Erkennung des Risikos einer zukünftigen Typ-1-Diabetes-Erkrankung auch eine Chance für Familien, sich auf die Insulin-Therapie vorzubereiten und damit auch die Stresssituation infolge einer tatsächlichen Diagnose deutlich zu verringern [Smith 2018].
Die Zulassung von Arzneimitteln zur Verzögerung einer Typ-1-Diabetes-Manifestation könnte schließlich zu einem greifbaren Nutzen der Früherkennung für Betroffene in Frühstadien führen. Kommende Studien werden hoffentlich zu einer besseren Einschätzung des langfristigen Nutzen-Risiko-Verhältnisses beitragen und klären, welche(r) Wirkstoff(e) für welches Individuum in welcher Dosis und Frequenz den größtmöglichen Benefit hervorrufen kann.
Abschließend lässt sich feststellen, dass eine Früherkennung von Typ-1-Diabetes langfristige gesundheitliche Vorteile nach sich ziehen kann und den Weg ebnet für zukünftig absehbare therapeutische Optionen, die die Insulinpflicht in einem vulnerablen Alter um Jahre hinauszögern könnten. Es sollten jedoch sowohl ethische Aspekte mit einer Betrachtung des Krankheitsbegriffs, psychologische Belastungen der Probanden und deren Angehöriger berücksichtigt werden, als auch logistische und strukturelle Anforderungen geklärt werden, bevor eine Typ-1-Diabetes-Früherkennung in einen breiten gesellschaftlichen Rahmen Einzug halten kann [Hendriks 2024].
- Die Früherkennung von Typ-1-Diabetes senkt die DKA-Inzidenz bei Manifestation signifikant und verbessert die glykämische Einstellung langfristig, kann jedoch auch mit psychischen Belastungen für die Betroffenen und deren Angehörige verbunden sein.
- Die Früherkennung von Typ-1-Diabetes schafft die Grundlage für therapeutische Interventionen, deren Zulassung mit Teplizumab als erstem Vertreter in diesem Bereich zukünftig erwartet werden kann.
- Möglichkeiten zur Früherkennung werden in Deutschland bisher nur im Rahmen von wissenschaftlichen Studien angeboten. Eine aktuell debattierte Ausweitung des Typ-1-Diabetes-Screenings in die Regelversorgung erfordert personelle, strukturelle und finanzielle Ressourcen, die auch die psychologische Betreuung von Personen und Angehörigen mit auffälligen Ergebnissen berücksichtigen muss.
|
|
Erschienen in: Diabetes, Stoffwechsel und Herz, 2024; 33 (5) Seite 247-257


