Ende August 2023 wurde während des ESC-Kongresses ein Update zu den Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) für Herzinsuffizienz veröffentlicht. Diese Ergänzung zu den aktuellen Leitlinien aus dem Jahr 2021 wurde von vielen Kardiologen bereits erwartet, da hiermit erstmals eine klare Therapieempfehlung für eine Substanzklasse bei Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) im deutsch-europäischen Raum ausgesprochen wurde. Aus diesem Anlass erhalten Sie nachfolgend einen praxisnahen Überblick über die aktuellen diagnostischen und therapeutischen Empfehlungen der ESC-Leitlinie speziell zu HFpEF.
Zusammenfassung
Die Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) stellt ein heterogenes klinisches Syndrom dar, dessen Diagnose und Therapie sich trotz steigender Prävalenz und schlechter Prognose nach wie vor als herausfordernd gestaltet. Neue Studienergebnisse zu SGLT-2-Inhibitoren führten nun erstmals zu einer universellen Therapieempfehlung für Betroffene mit HFpEF in dem Ende August 2023 veröffentlichten fokussierten Update der ESC-Leitlinien 2021 zur akuten und chronischen Herzinsuffizienz. Dieser Artikel gibt Ihnen einen praxisorientierten Überblick über die aktuellen diagnostischen und therapeutischen Maßnahmen, die darin für Patienten mit HFpEF empfohlen werden. SchlüsselwörterESC, Leitlinien, HFpEF, Herzinsuffizienz, SGLT-2-Inhibitoren
2023 Focused Update of the 2021 ESC Guidelines on heart failure: Key recommendations on the diagnosis and management of HFpEF
Summary
Heart failure with preserved ejection fraction (HFpEF) is a heterogeneous clinical syndrome that remains challenging to diagnose and to treat despite its increasing prevalence and poor prognosis. However, new trial results on SGLT-2 inhibitors have now led to the first universal therapy recommendation for individuals with HFpEF in the focused update of the 2021 ESC guidelines on acute and chronic heart failure published at the end of August. This article provides a practical overview of the current diagnostic and therapeutic recommendations for people with HFpEF. Keywords
ESC, guidelines, HFpEF, heart failure, SGLT-2 inhibitors
Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF)
Definition der HFpEF
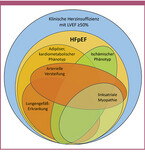
Die Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF) ist ein heterogenes klinisches Syndrom unterschiedlicher Ätiologie, das in Abgrenzung zur Herzinsuffizienz mit reduzierter (HFrEF, LVEF ≤40%) oder mäßiggradig reduzierter Ejektionsfraktion (HFmrEF, LVEF 40-49%) über eine erhaltene Ejektionsfraktion (EF) ≥50% im Zusammenhang mit weiteren Kriterien definiert ist (Tabelle 1). Aufgrund der vielfältigen Ursachen, die für die Symptomatik der Herzinsuffizienz infrage kommen und der sich daraus ergebenden unterschiedlichen therapeutischen Optionen, ist die sorgfältige (Differential-)Diagnose primär ursächlicher Erkrankungen von zentraler Bedeutung (Abbildung 1).
Epidemiologie
In Deutschland weisen etwa 50% der Patienten mit Herzinsuffizienz eine HFpEF auf [Tiller 2013]. Anders als HFrEF, deren Inzidenz Prognosen zufolge in den kommenden Jahren durch die Fortschritte in der Behandlung akuter kardiovaskulärer Syndrome als zentralem Risikofaktor weltweit abnehmen wird, nimmt die Prävalenz der HFpEF auf Basis der aktuellen demografischen Entwicklung weiter zu [Savarese 2023]. Gemeinsam ist HFpEF- und HFrEF-Patienten jedoch eine ungünstige Prognose – so lag die Fünf-Jahres-Mortalitätsrate in einer großen amerikanischen Studie mit Beobachtungszeitraum bis 2009 in beiden Fällen über 60% [Tsao 2018].
Pathophysiologie
Während bei HFpEF im Gegensatz zu HFrEF nicht primär die systolische Funktion, sondern durch eine erhöhte Steifigkeit des linken Ventrikels die Relaxation beeinträchtigt ist, ging man lange davon aus, dass es sich um eine isolierte, diastolische Dysfunktion handelt [Zile 2004]. Nach heutigem Verständnis kann HFpEF jedoch vielmehr als ein organübergreifendes, systemisches Syndrom angesehen werden [Shah 2020]. So liegt bei 60-80% der HFpEF-Patienten in der Anamnese eine arterielle Hypertonie vor, 30-40% sind adipös und 20-40% haben einen T2D [Anker 2023]. Als möglicher Zusammenhang wird eine chronische Entzündungsreaktion infolge systemischer Komorbiditäten diskutiert [Paulus 2013]. Der genaue Zusammenhang zu einer kardialen Manifestation der HFpEF ist dabei nicht vollständig geklärt. Eine chronische systemische Inflammation kann jedoch eine endotheliale Dysfunktion mit verminderter myokardialer Verfügbarkeit von Stickstoffmonoxid und in der Folge ein pro-inflammatorisches, fibrotisches Remodelling der Kardiomyozyten begünstigen [Borlaug 2023]. Eine daraus resultierend erhöhte Steifigkeit des Myokards manifestiert sich schließlich in erhöhten linksventrikulären Füllungsdrücken unter Belastung oder in Ruhe [Westermann 2008], die jedoch auch simultan mit einer rechtsventrikulären Dysfunktion und im weiteren Verlauf häufig mit Vorhofflimmern einhergehen kann [Borlaug 2023]. Innerhalb der gemeinsamen Diagnose HFpEF können jedoch auch andere pathophysiologische Prozesse im Vordergrund stehen.
BNP: B-Typ-natriuretisches Peptid
ESC: European Society of Cardiology (Europäische Gesellschaft für Kardiologie)
HFmrEF: Herzinsuffizienz mit mäßiggradig reduzierter Ejektionsfraktion
HFpEF: Herzinsuffizienz mit erhaltener Ejektionsfraktion
HFrEF: Herzinsuffizienz mit reduzierter Ejektionsfraktion
KHK: koronare Herzkrankheit
LVEF: linksventrikuläre Ejektionsfraktion
MRA: Mineralkortikoid-Rezeptorantagonist
NT-proBNP: N-terminales Prohormon des B-Typ natriuretischen Peptids
SGLT-2: Sodium glucose linked transporter 2 (Natrium-Glukose-Transporter 2)
T2D: Diabetes mellitus Typ 2
ESC-Leitlinien 2023: Aktuelle Empfehlungen zur Diagnostik der HFpEF
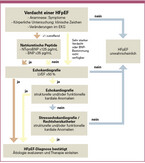
Für die Diagnose der HFpEF haben sich im Update der Leitlinien keine Neuerungen ergeben, sodass die Empfehlungen der ESC-Leitlinie aus dem Jahr 2021 unverändert gelten. Abbildung 2 gibt Ihnen einen Überblick über das an die Empfehlungen für die HFpEF angepasste Diagnoseschema, das auf einer Abklärung dreier zentraler Elemente beruht:
1. Dem Vorhandensein von Symptomen und klinischen Zeichen der Herzinsuffizienz (Tabelle 1)
2. einer LVEF ≥50%
3. sowie dem Nachweis struktureller und/oder funktioneller Anomalien, die auf eine HFpEF hinweisen (Tabelle 2)
Zentrale Rolle der Echokardiografie – NT-proBNP-Werte bei HFpEF häufig nicht verändert
Für die Diagnose einer HFpEF ist eine Echokardiografie zur Bestimmung der LVEF unumgänglich. Der Nachweis erhöhter B-Typ-natriuretischen Peptide BNP oder NT-proBNP im Plasma (siehe Tabelle 2) kann jedoch die Bestätigung weiterer struktureller oder funktioneller Auffälligkeiten ersetzen. Ein Anstieg dieser Werte basiert auf einer erhöhten enddiastolischen Wandspannung. Durch das bei HFpEF typischerweise verdickte Myokard sind jedoch bei etwa 30% der HFpEF-Patienten – insbesondere bei denjenigen mit Adipositas – keine über die Grenzwerte erhöhten BNP-Werte nachweisbar [Borlaug 2023].
Weiterführende Untersuchungen häufig notwendig
Ebenso weisen etwa 35% der Patienten mit HFpEF keine eindeutigen körperlichen, radiologischen oder echokardiographischen Anzeichen einer Herzinsuffizienz in Ruhe auf [Redfield 2023]. Aus diesem Grund gilt eine invasive hämodynamische Untersuchung mittels Rechtsherzkatheter nach wie vor als diagnostischer Goldstandard, um eine HFpEF sicher nachzuweisen. Eine solche aufwändige und mit Risiken verbundene Untersuchung ist jedoch explizit nur bei uneindeutigen Ergebnissen aus den vorherigen Tests empfohlen [McDonagh 2021].
Bei Patienten mit Komorbiditäten an HFpEF denken
Durch die Abwesenheit eines nicht-invasiven Goldstandards zum eindeutigen Nachweis einer HFpEF gestaltet sich die Diagnose leider nach wie vor schwierig. So wird eine hohe Dunkelziffer für die HFpEF-Prävalenz vermutet, insbesondere unter Menschen mit Adipositas [Obokata 2022]. Daneben erhöhen eine Hypertonie, Typ-2-Diabetes (T2D), ein zurückliegender Myokardinfarkt und chronisch obstruktive Lungenerkrankung (COPD) neben einem hohen Alter das Risiko für eine HFpEF deutlich [Gaziano 2021]. Darum sollte insbesondere bei von diesen Komorbiditäten Betroffenen mit unklaren pulmonalen Beschwerden in Ruhe oder unter Belastung immer auch eine HFpEF in Erwägung gezogen werden.
HFpEF-Ätiologien und Differentialdiagnostik
Da die HFpEF eine uneinheitliche Erkrankungsentität darstellt, sollte über die Diagnosestellung hinaus stets die in Frage kommende Ätiologie der HFpEF beleuchtet werden, einschließlich der Differentialdiagnose zu anderen Krankheitsbildern, die einer HFpEF ähneln, dieser jedoch nach diagnostischen Kriterien nicht entsprechen [Anker 2023]. Diese umfassen etwa eine koronare Herzkrankheit (KHK), verschiedene Formen von Kardiomyopathien, Herzklappenerkrankungen, eine Amyloidose, Myokarditis und Kollagenosen, aber auch einige nicht-kardiovaskuläre Erkrankungen wie chronische Lungenerkrankungen, chronische Niereninsuffizienz (CKD), Lebererkrankungen, Erkrankungen aus dem rheumatoiden Formenkreis, Anämie und venöse Insuffizienz [Kittleson 2023].
ESC-Leitlinien 2023: Aktuelle Empfehlungen zur Therapie der HFpEF
Große Defizite bei den bisherigen Therapieoptionen
Während die Behandlung der HFrEF durch die vier Medikamentenklassen ACE-Hemmer beziehungsweise Angiotensin-Rezeptor-Neprilysin-Inhibitoren (ARNI), Betablocker, Mineralkortikoid-Rezeptorantagonisten (MRA) und SGLT-2-Inhibitoren gut gesichert ist, lagen für die HFpEF bis vor kurzem keine allgemein empfohlenen Pharmakotherapien vor, die über die symptomatische Behandlung einer Volumenüberlastung mittels Diuretika hinausgingen [McDonagh 2021]. Mit SGLT-2-Inhibitoren steht nun jedoch eine Arzneimittelklasse zur Verfügung, die nicht nur bei Patienten mit HFrEF, sondern auch bei HFmrEF- und HFpEF-Patienten nachweislich eine klinisch wie statistisch signifikante Verbesserung der Prognose ermöglicht.
SGLT-2-Inhibitoren: Signifikanter klinischer Benefit bei HFpEF
Die EMPEROR-Preserved-Studie [Anker 2021] wurde im Herbst 2021 veröffentlicht und untersuchte Herzinsuffizienz-Patienten mit einer LVEF >40% sowie erhöhtem NT-proBNP-Wert. Nach einer mittleren Beobachtungszeit von etwa zwei Jahren war der kombinierte primäre Endpunkt aus Hospitalisierung und dringenden ambulanten Besuchen aufgrund von Herzinsuffizienz oder kardiovaskulär bedingtem Tod mit Empagliflozin um 21% reduziert. Im darauffolgenden Jahr wurden die Ergebnisse der DELIVER-Studie [Solomon 2022] präsentiert. Auch hier sank das Risiko für den kombinierten primären Endpunkt aus Hospitalisierung aufgrund von Herzinsuffizienz oder kardiovaskulär bedingtem Tod in einer vergleichbaren Patientenpopulation nach 2,3-jähriger Behandlung mit Dapagliflozin um 18%. Die Effekte beruhten in beiden Studien maßgeblich auf einem Rückgang der Hospitalisierungen, galten jedoch gleichermaßen für Patienten mit und ohne Diabetes.
Auch eine nachfolgende Meta-Analyse beider Studien bestätigte ein um 20% niedrigeren Risiko für den kombinierten primären Endpunkt sowie ein um 26% verringertes Risiko für eine erste Hospitalisierung aufgrund von Herzinsuffizienz [Vaduganathan, Docherty, 2022]. Das Risiko für einen kardiovaskulär bedingten Tod war statistisch nicht signifikant verändert. Eine gepoolte Meta-Analyse der beiden Dapagliflozin-Studien DELIVER und DAPA-HF (LVEF ≤40%) zeigte jedoch für Dapagliflozin über das gesamte Spektrum der LVEF hinweg eine signifikante Senkung des Risikos eines kardiovaskulär bedingten Todes um 14% [Jhund 2022].
Klasse IA-Empfehlung für Empagliflozin und Dapagliflozin bei HFpEF
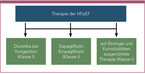
Darauf basierend wurden die SGLT-2-Inhibitoren Dapagliflozin und Empagliflozin in der nun ergänzten Leitlinie der ESC erstmalig mit einer höchsten Empfehlung der Klasse I und Evidenzlevel A, in den Behandlungsalgorithmus für HFpEF aufgenommen (Tabelle 3) [McDonagh 2023].
Die Wirkung von SGLT-2-Inhibitoren bei HFpEF tritt rasch ein: Eine statistisch signifikante Senkung des primären Endpunkts wurde mit Dapagliflozin in DELIVER bereits nach 13 Tagen und bei Empagliflozin 18 Tage nach Behandlungsbeginn beobachtet [Vaduganathan, Claggett, 2022; Butler 2022]. Dapagliflozin und Empagliflozin können auf Grundlage der Studiendaten bis zu einer glomerulären Filtrationsrate (GFR) von ≥25 beziehungsweise ≥20 mL/min/1,73 m² eingesetzt werden. Eine geringe, initiale Senkung der glomerulären Filtrationsrate nach Therapiebeginn ist normal und reversibel. Neben häufigen, jedoch meist unkomplizierten Genital- und Harnwegsinfektionen und seltenen Fällen einer diabetischen Ketoazidose sind SGLT-2-Inhibitoren dabei in der Regel gut verträglich [Vaduganathan, Docherty, 2022].
Weitere Therapieoptionen leiten sich von der Symptomatik, der Ätiologie und eventuellen Komorbiditäten ab
Bei Patienten mit Volumenüberlastung sind darüber hinaus weiterhin Diuretika indiziert [McDonagh 2023]. Im Sinne eines Patient Profiling leitet sich die weitere Therapie, ebenfalls eine Klasse-I-Empfehlung, vom jeweiligen Phänotyp der HFpEF ab (Abbildung 3) [Anker 2023]. Somit ist die Behandlung sowohl der HFpEF-Ätiologien als auch etwaiger Komorbiditäten der dritte Pfeiler der HFpEF-Therapie, der nun durch das aktuelle Update der Leitlinienempfehlungen mehr Gewicht erhielt. Tatsächlich werden aufgrund der Häufigkeit von Komorbiditäten wie arterieller Hypertonie oder KHK viele Patienten bereits mit ACE-Hemmern oder Sartanen und Betablockern behandelt [Vaduganathan, Docherty, 2022]. Eine weitere Neuerung ergibt sich jedoch auch im Bereich der Prävention: So wurde neben einer Empfehlung für Dapagliflozin und Empagliflozin auch eine neue Klasse-IA-Empfehlung für den nicht-steroidalen MRA Finerenon zur Prävention einer Herzinsuffizienz bei Patienten mit T2D und CKD aufgenommen [McDonagh 2023].
Weitere Empfehlungen aus dem neuen Leitlinien-Update
Auch für die Therapie der HFmrEF liegt mit dem Leitlinien-Update der ESC nun eine gleichlautende Klasse IA-Empfehlung für Dapa- und Empagliflozin vor. Ebenso wurde, basierend auf Ergebnissen der IRONMAN-Studie und einer diese einschließenden Meta-Analyse, jedoch nicht in Anbetracht der zeitgleich zum Leitlinien-Update veröffentlichten Ergebnisse der HEART-FID-Studie, die Empfehlung einer Eisen-Gabe hochgestuft [Graham 2023]: So ist eine intravenöse Eisen-Supplementierung nun für symptomatische Patienten mit HFrEF und HFmrEF und Eisenmangel zur Symptomlinderung und Verbesserung der Lebensqualität (Klasse IA) empfohlen. Weiterhin ergeben sich Änderungen zur ESC-Leitlinie bei der Behandlung der akuten Herzinsuffizienz. Hierbei wird nun eine explizite Empfehlung der Klasse IB für die frühzeitige Einleitung einer evidenzbasierten Behandlungsstrategie unter regelmäßiger Kontrolle innerhalb der ersten sechs Wochen bei Patienten, die aufgrund von Herzinsuffizienz hospitalisiert wurden, ausgesprochen. Diese Hochstufung des Empfehlungsgrades beruht auf den Ergebnissen der STRONG-HF Studie [Mebazaa 2022].
- HFpEF ist ein heterogenes klinisches Syndrom, hinter dem sich multiple Erkrankungen verbergen können
- Klare Kriterien für die Diagnose einer HFpEF sind Symptome und klinische Zeichen, eine LVEF ≥50% sowie der objektive Nachweis struktureller und/oder funktioneller kardialer Anomalien
- Patienten sollten darüber hinaus nach Ätiologie und Phänotyp der HFpEF charakterisiert und behandelt werden, was die individuelle Symptomatik und relevante Komorbiditäten einschließt
- Differentialdiagnostisch relevante Erkrankungen sind unter anderem Kardiomyopathien, Herzklappenerkrankungen und chronische Lungenerkrankungen
- Dapagliflozin und Empagliflozin weisen über das gesamte Spektrum der LVEF und unabhängig davon, ob ein T2D besteht oder nicht, einen signifikanten klinischen Benefit für Patienten mit Herzinsuffizienz auf
- Dapagliflozin und Empagliflozin sind für alle HFpEF-Patienten indiziert und sollten frühzeitig eingesetzt werden
- Diuretika sind bei venöser Kongestion indiziert.
Erschienen in: Diabetes, Stoffwechsel und Herz, 2023; 32 (6) Seite 292-297