Wie kann eine Phänotypisierung bei der Diabetesbehandlung helfen? Professor Andreas Pfützner berichtet über seine Erfahrungen in der Praxis. Lesen Sie im zweiten Teil, wie eine personalisierte und individuelle Therapie aussehen könnte.
Typ-2-Diabetes ist eine hochkomplexe multifaktorielle Erkrankung, die aus mehreren ineinandergreifenden Grundstörungen (ß-Zelldysfunktion, Insulinresistenz, hormonelle Hyperaktivität des viszeralen Fettgewebes und chronisch systemische Inflammation) besteht. Die aktuelle Diabetestherapie zielt praktisch ausschließlich auf die Behandlung des Blutzuckers (HbA1c) sowie auf die Vermeidung von diabetischen Spätkomplikationen hin. Sie beginnt mit Lebensstilmaßnahmen, regelhaft gefolgt von einer initialen Metformin-Monotherapie und wird stufenweise auf am Ende bis zu vier Medikamente gleichzeitig eskaliert, wobei die Gabe von Insulin erst als letzte Option vorgesehen ist, wenn alle vorherigen Maßnahmen nicht mehr greifen [ElSayed 2023, Landgraf 2023; BÄK 2021]. Diese standardisierte Vorgehensweise wird der eigentlichen Pathophysiologie der Erkrankung allerdings kaum gerecht und sorgt dafür, dass hocheffektive Behandlungsmaßnahmen mit massivem therapeutischem Potential, wie z.B. eine frühzeitige Insulintherapie, nur sehr sporadisch oder gar nicht zum Einsatz kommen. Der Typ-2-Diabetes wird dadurch zu einer chronisch progredienten Erkrankung, die nach jahre- bis jahrzehntelanger "Verwaltung" des HbA1c-Werts beinahe schicksalshaft zum Tod durch makrovaskuläre oder mikrovaskuläre Ereignisse führt. Im Mittel dauert es ca. 10-14 Jahre, bis nach der Diagnose des Diabetes über die Hyperglykämie eine Insulintherapie eingeleitet wird, und die Lebenserwartung der Menschen mit Typ-2-Diabetes ist immer noch verkürzt [Ringborn 2010, Bernstein 2023, Emerging Risk Factor Collaboration, 2023, Salvador 2023].
In meiner Praxis wird abweichend von der üblichen Vorgehensweise (Standard of Care) eine Therapie durchgeführt, die sich an einer vorher stattgefundenen Phänotypisierung mit funktionellen Biomarkern [Pfützner 2008; Pfützner 2023] orientiert und bei der insbesondere Medikamente zum Einsatz kommen, die die Grundstörung mit dem schwersten Ausprägungsgrad möglichst effizient behandeln (Standard of Care plus, SOC+). Wir versuchen dabei möglichst Leitlinien-gerecht vorzugehen, wollen aber gleichzeitig auch nicht auf den frühzeitigen Einsatz von Medikamenten verzichten, die insbesondere gegen die individuelle Komposition der Grundstörungen gerichtet sind.
Wie greifen aktuelle Medikamente in die Pathophysiologie des Typ-2-Diabetes ein?
Vorab – alle Medikamente, die zur Behandlung des Diabetes mellitus zugelassen sind, senken den Blutzucker (siehe Tab. 1), und Lebensstilmaßnahmen verbessern die pathophysiologische Gesamtsituation, sofern sie zielgerichtet durchgeführt werden. Bei einer ausschließlich glukozentrisch orientierten Therapie ist es daher natürlich vertretbar, immer zuerst Metformin einzusetzen und bei Bedarf Sulfonylharnstoffe dazuzugeben. Mit dieser Vorgehensweise kann den Blutzucker sicherlich für einige Jahre gut "verwaltet" werden, allerdings entwickelt sich aufgrund der in Teil 1 (Diabetes-Forum 1/2, 2024) dargelegten Pathophysiologie nahezu ungebremst das makrovaskuläre Geschehen mit entsprechenden Konsequenzen. Es muss sogar davon ausgegangen werden, dass Sulfonylharnstoffe das pathologische Geschehen beschleunigen und gewissermaßen einen "Zusatzschaden" anrichten. Dazu mehr weiter unten im Abschnitt zu den Sulfonylharnstoffen. Im Folgenden werden die zur Verfügung stehenden Medikamente kurz anhand Ihrer aktuellen Datenlage hinsichtlich ihres Einflusses auf die pathophysiologischen Grundstörungen betrachtet.
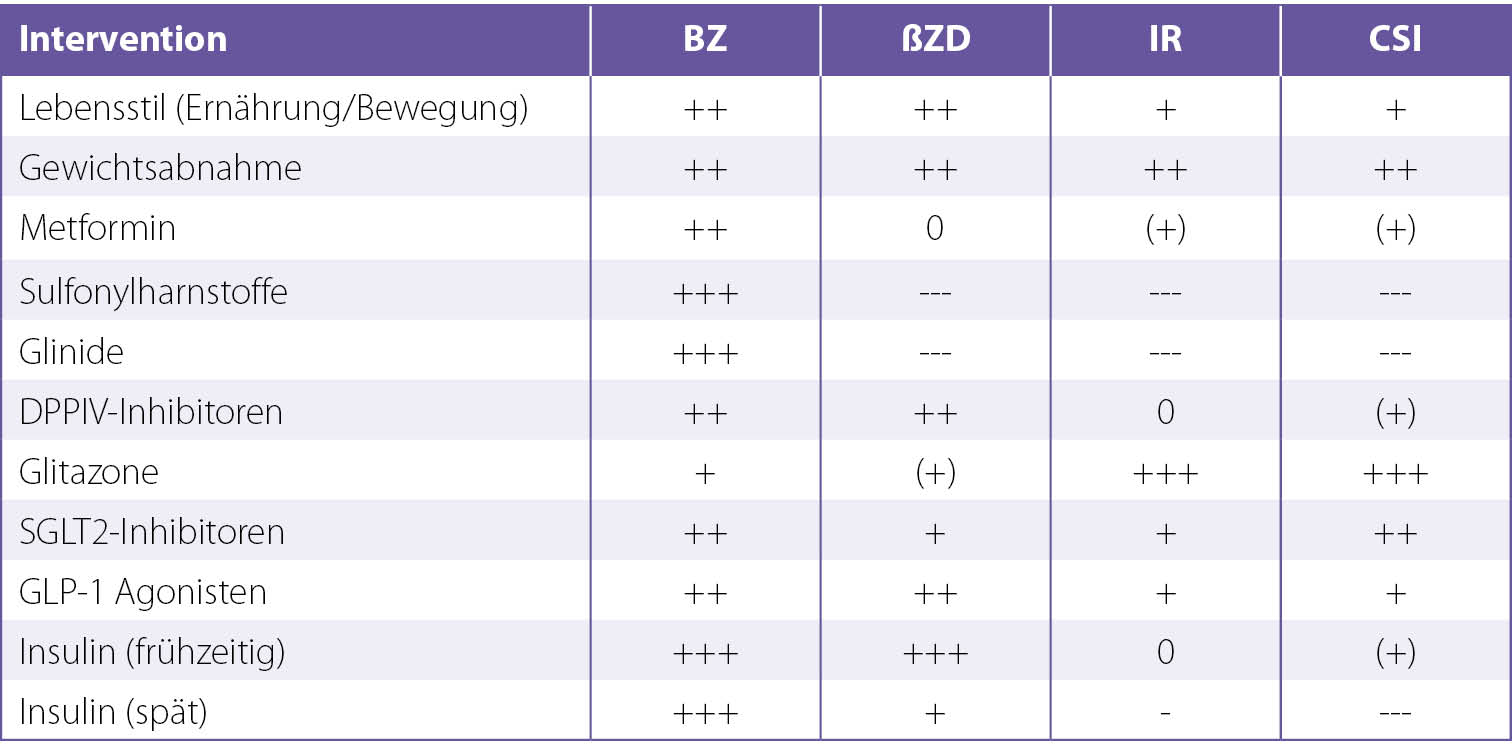 Tab. 1: Einfluss antidiabetischer Interventionen auf die pathophysiologischen diabetischen Grundstörungen
Tab. 1: Einfluss antidiabetischer Interventionen auf die pathophysiologischen diabetischen Grundstörungen
Metformin
Metformin ist unbestritten das First-line-Medikament in allen nationalen und internationalen Therapieleitlinien [z.B. ElSayed 2023, Landgraf 2023]. Sein Wirkmechanismus ist eine Blockade der hepatischen Glukoneogenese, was insbesondere zur Reduktion der Glukoseversorgung zwischen den Mahlzeiten führt [Bailey 1996; Frayn 1971; Hundal 2000]. Des Weiteren werden Metformin noch einige weitere positive pleiotrope Effekte insbesondere beim kardiovaskulären Risiko nachgesagt, die jedoch nicht wirklich durch Studien belegt sind. Als positives Argument für eine kardioprotektive Wirkung von Metformin wird gerne eine Subgruppe der UKPDS-Studie herangezogen, bei der 342 Metformin-behandelte Patienten eine signifikante Reduktion der kardiovaskulären Mortalität aufwiesen [UKPDS 1998]. Hierbei wird gerne übersehen, dass diese Patienten zu Beginn der Studie deutlich übergewichtig waren und im Verlauf äusserst erfolgreich Gewicht abgenommen haben (obwohl die Lipolyse eigentlich durch Metformin behindert war). Sämtliche anderen Belege einer kardioprotektiven Metforminwirkung stammen aus Studien in denen Metformin mit Sulfonylharnstoffen verglichen wurde, die jedoch ihrerseits das kardiovaskuläre Risiko erhöhen [z.B. Hermann 1999; Han 2021; Li 2022]. Es gibt fast keine direkten Monotherapie-Vergleichsstudien zwischen Metformin und moderneren Antidiabetika. Eine Ausnahme ist die prospektive randomisierte ADOPT-Studie, bei der im Paralleldesign der Einfluss von Sulfonylharnstoffen, Metformin, und Rosiglitazon auf die Diabetesprogression (gemessen über die Zeit bis zur Notwendigkeit einer zusätzlichen Medikation zur ausreichenden Senkung des HbA1c) untersucht wurde. In dieser Studie war Metformin zwar dem Sulfonylharnstoff überlegen, aber Rosiglitazon war signifikant besser als Metformin [Kahn 2006 und 2011]. Ich betrachte Metformin als reinen Blutzuckersenker, der ansonsten hinsichtlich der Pathophysiologie eher als neutral anzusehen ist. Sicherlich ist es kein systemischer Insulinsensitizer, auch wenn dies beharrlich in der Literatur kolportiert wird [Lord 1983]. Metformin hat z.B. keine mir bekannten Wirkungen auf die vaskulären Insulinrezeptoren.
Des Weiteren führt Metformin bei etwa der Hälfte der Patienten zu gastrointestinalen Nebenwirkungen, die ich meinen Patienten angesichts von besser verträglichen Alternativen (z.B. SGLT-2-Inhibitoren oder DPP-IV-Inhibitoren) gerne erspare. Ich setze Metformin daher als blutzuckersenkende Komponente ein, wenn der Patient deutlich erhöhte Blutzuckerwerte hat und andere Therapieoptionen z.B. aufgrund von Kontraindikationen nicht in Betracht kommen.
Sulfonylharnstoffe und Glinide
Sulfonylharnstoffe (SH) und Glinide halte ich persönlich heutzutage für obsolet. Ihr Wirkmechanismus, eine unkontrollierte Eröffnung der natriumabhängigen Kanäle der B-Zellen führt zur vorzeitigen Erschöpfung der Spaltungskapazitäten in den ß-Zellen und treibt die negative pathophysiologische Entwicklung voran. Es gibt zahlreiche Publikationen mit höchstem Evidenzwert, die den negativen Einfluss der SH auf die kardiovaskuläre Mortalität belegen [Forst 2013; Bain 2016]. Als ein eher unterhaltsames Beispiel möchte ich an dieser Stelle eine Meta-Analyse von Krankenkassendaten aus Kanada zitieren, bei der untersucht wurde, welchen Einfluss die Compliance der Patienten hinsichtlich der Einnahme ihrer anti-diabetischen Medikation auf die Mortalität hat. Während die Einnahme oder die Nicht-Einnahme von Metformin in dieser Untersuchung keinen Einfluss auf die Mortalität hatte, starben Patienten tatsächlich signifikant häufiger, wenn sie Ihren Sulfonylharnstoff auch wirklich regelmäßig einnahmen (s. Abb. 1, [Simpson 2006]). Aufgrund der negativen Auswirkungen der Sulfonylharnstoffe und in etwas abgeschwächter Form auch der Glinide, setze ich beide Medikamentenklassen in meiner personalisierten Therapie nicht ein.
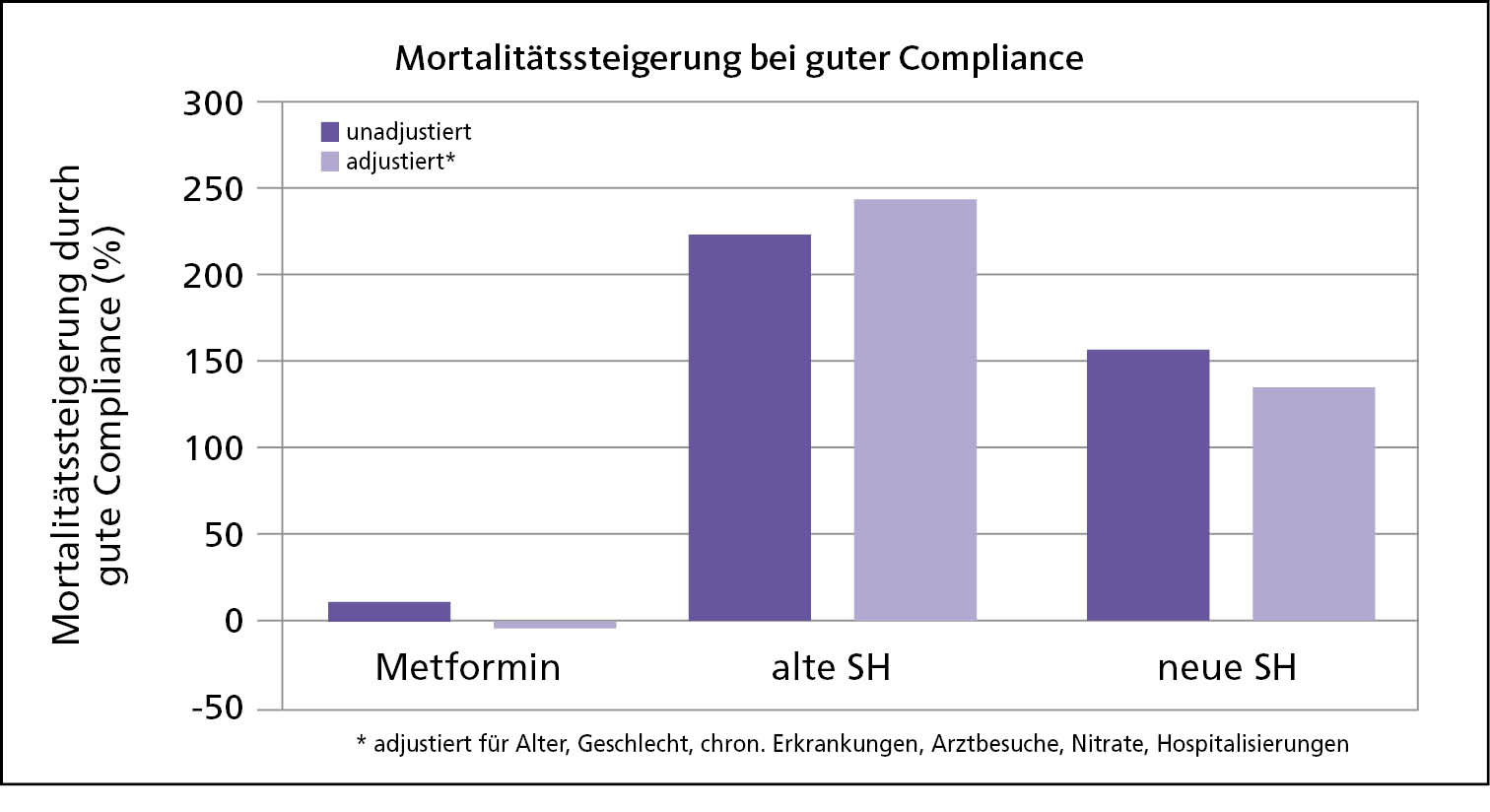 Abb. 1: Einfluss einer guten Patientencompliance auf die Mortalität [nach Simpson et al., 2006].
Abb. 1: Einfluss einer guten Patientencompliance auf die Mortalität [nach Simpson et al., 2006].
DPP-IV-Inhibitoren
Die Hauptwirkung der Dipeptidylpeptidase-4 (DPP-IV)-Inhibitoren besteht darin, den Abbau von Inkretinhormonen wie GLP-1 (Glucagon-like Peptide-1) und GIP (Gastric Inhibitory Polypeptide) zu hemmen [Holst 1998]. Diese Hormone werden bekanntlich nach der Nahrungsaufnahme freigesetzt und spielen eine wichtige Rolle bei der Regulierung des Essverhaltens und des Blutzuckerspiegels [Gautier 2005]. Durch die Hemmung des Enzyms DPP-IV wird der Abbau von GLP-1 und GIP verlangsamt, was zu einer verstärkten Insulinfreisetzung aus der Bauchspeicheldrüse führt – insbesondere in Reaktion auf erhöhte Blutzuckerspiegel. Des Weiteren kommt es zur Reduzierung der Glukagonfreisetzung [Diamant 2005; Gautier 2005], zur Verlangsamung der Magenentleerung [McIntosh 2005], und konsekutiv zu einer verlangsamten Aufnahme von Glukose in den Blutkreislauf und zur Reduktion von postprandialen Blutzuckerspitzen [Gautier 2005]. Da GLP-1 bekanntlich auch das Sättigungsgefühl beeinflusst, können Gliptine zu einer reduzierten Nahrungsaufnahme und potenziell zur Gewichtsabnahme beitragen [Hansen 2014]. In meinen Therapieschemata kommen DPP-IV-Inhibitoren zum Einsatz, wenn es z.B. darum geht bei einem übergewichtigen Insulinresistenz-Phänotyp die Wirkung der GLP1-Haupttherapie zu unterstützen.
Glitazone
Glitazone sind PPARγ-Agonisten und verstärken das Insulinsignal in peripheren Geweben und an den Blutgefäßen [Forman 1996]. Sie erhöhen insbesondere die Empfindlichkeit von Muskel- und Fettgewebe gegenüber Insulin. Diese Gewebe reagieren dann effektiver auf Insulin, mehr Glukose aus dem Blut wird aufgenommen und der Blutzuckerspiegel sinkt [Goldstein 1999, Barnett 2002]. Durch die Verbesserung der Insulinsensitivität blockieren die Glitazone auch die hepatische Glukoneogenese [Raman 2000, Shannon 2017]. Im Gegensatz zu Rosiglitazon beeinflusst Pioglitazon außerdem die Verteilung des Körperfetts, da es die Lagerung von subkutanem Fett fördert und die Ansammlung von viszeralem Fett in Organen wie der Leber und den Muskeln verringert [deSouza 2001; King 2002; Miyzaki 2002]. Es reduziert die Triglyzeridspiegel [Nass 2000; Forst 2008], senkt die Menge an kleinen atherogenen LDL-Partikeln [Hanefeld 2007; Leonhardt 2008] und steigert die HDL-Cholesterinkonzentrationen [Nass 2000, King 2002]. Aufgrund dieser Eigenschaften ist Pioglitazon auch für die Behandlung der nicht-alkoholischen Steatohepatitis sehr gut geeignet [Deng 2023]. Die für mich wichtigsten Wirkungen des Pioglitazons sind jedoch seine anti-inflammatorischen Eigenschaften, die zu einer Reduktion der chronisch-systemischen Inflammation beitragen. Wir konnten in einer Studie zeigen, dass sich durch Pioglitazon z.B. die Aktivierung von peripheren Monozyten/Makrophagen (gemessen über die Exprimierungsrate proinflammatorischer Zytokine) schon innerhalb von drei Tagen um ca. ein Drittel reduzieren läßt [Pfützner 2011], was langfristig zur Verbesserung des kardiovaskulären Risikos [Pfützner 2006c; Pfützner 2007, Betteridge 2009; Pfützner 2010] und z.B. zu einer Reduktion der Intima-Media-Dicke als Indikator für die Atherosklerose führen kann [Langenfeld 2005, Mazzone 2006, Polonsky 2009]. Bei meinen Therapien kommt daher von den Glitazonen bevorzugt Pioglitazon zum Einsatz und ist eine der Hauptkomponenten bei der Therapie des Insulinresistenz-Phänotyps und insbesondere auch des CSI-Phänotyps.
Die häufigsten Nebenwirkungen von Pioglitazon sind ggfs. eine Flüssigkeitsretention, die zu einer kurzzeitigen Gewichtszunahme führen kann und damit verbunden ein erhöhtes Risiko für die Manifestation einer Herzinsuffizienz bei einem bereits vorgeschädigten Organ. Des Weiteren wurden bei langjähriger Einnahme und hierbei insbesondere bei Frauen in der Menopause mit High-Turnover Osteoporose ein erhöhtes Risiko für Frakturen der Knochen an den Extremitäten beobachtet [Murphy 2014]. Flüssigkeitsretention, Gewichtszunahme, Ödeme und beschleunigte Manifestation einer Herzinsuffizienz sind hierbei Nebenwirkungen, die auf eine verbesserte Insulinwirkung zurückzuführen sind und die ggfs. ebenfalls beim Beginn einer Insulintherapie beobachtet werden können [Kermani 2003; Tang 2003; Chelliah 2004; Herrero 2023]. Mit jedem Molekül Glukose, dass z.B. über den GLUT1-Transporter in die Zellen gelangt, werden auch 6 Moleküle Kristallwasser eingeschleust [Deng 2015; Custódio 2021], wodurch sich die Gesamtmenge an Wasser im Körper bei adäquater Flüssigkeitsaufnahme erhöht. An dieser Stelle sei angemerkt, dass die gesteigerte Hydratation der Gehirnzellen bei Einleitung einer Glitazon- oder Insulintherapie zu einer deutlichen Stimmungsaufhellung bei Patienten mit depressiver Verstimmung führen kann [Kashani 2012; Lin 2015; Colle 2017; Ikram 2021].
Leider wird Pioglitazon von den gesetzlichen Krankenkasse aufgrund vermeintlicher Sicherheitsbedenken (Blasen-Ca) nur in Ausnahmefällen erstattet [Zhu 2012; Ferwana 2013]. Obwohl mittlerweile erwiesen ist, dass die Studien, die zu den Sicherheitsbedenken führten, methodisch äusserst fragwürdig sind [Ripamonti 2019, deVries 2020] und dass die Substanz nicht wirklich zu einem erhöhten Blasenkrebsrisiko führt [Ryder 2019; Li 2021], wurde auf eine Neubewertung dieser Situation durch den gemeinsamen Bundesausschuss (GBA) bislang verzichtet. Dies ist betrüblich, da dadurch dieses nachweislich das Infarkt- und Schlaganfall-Risiko senkende und anti-inflammatorisch potente Medikament in Deutschland nur bei Privatpatienten und Selbstzahlern eingesetzt werden kann und kaum Generika zur Verfügung stehen. Ich verweise meine selbstzahlenden Patienten daher gerne auf die Internet-Adresse einer holländischen Versandapotheke, die Pioglitazon für ein Drittel des deutschen Apothekenpreises bereithält. In allen anderen Ländern der Welt ist ein derartiges Problem nach meinen Informationen nicht existent und Pioglitazon ist preiswert verfügbar!
GLP-1-Agonisten
GLP-1-Agonisten (Glucagon-like Peptide-1-Agonisten) ahmen die Wirkung des natürlichen Inkretinhormons GLP-1 nach, das eine wichtige Rolle bei der Regulierung von Stoffwechsel und Appetitverhalten spielt [Stanley 2004; Wren 2007]. GLP-1 Agonisten stimulieren die Bauchspeicheldrüse, sodass in Reaktion auf erhöhte Blutzuckerspiegel mehr Insulin freigesetzt wird. Diese Insulinausschüttung ist wie bei den DPP-IV-Inhibitoren glukoseabhängig, wodurch das Risiko einer Hypoglykämie verringert ist [Vilsbøll 2000 und 2001, Kjems 2003]. Darüber hinaus haben neuere Studien (z.B. die LEADER-Studie mit Liraglutide) gezeigt, dass GLP-1-Agonisten kardiovaskuläre Vorteile bieten können [Nauck 2018; Vemulapalli 2023]. GLP-1-Agonisten hemmen auch die Glukagon-Freisetzung und damit die hepatische Glukoneogenese, verzögern die Magenentleerung und induzieren im Gehirn ein Sättigungsgefühl durch Anbindung an entsprechende hypothalamische Rezeptoren [Krieger 2020, Kabahizi 2023]. GLP-1-Agonisten werden i.d.R. subkutan appliziert und sind mit unterschiedlichen Wirkdauern verfügbar. Ich setze GLP-1-Agonisten generell bei Patienten ein, die von einer Gewichtsabnahme profitieren können, und in höheren Dosen insbesondere beim Insulinresistenz- bzw. beim CSI-Phänotyp.
Ich bevorzuge dabei aus pathophysiologischen Überlegungen heraus die kurz-wirkenden GLP1-Agonisten (Exenatide, Lixisenatide, Liraglutide) vor den langwirkenden Präparaten (Once-weekly-Exenatide, Semaglutide). GLP-1 wird im Körper physiologischerweise sehr schnell abgebaut und ist nach einer Mahlzeit nur für wenige Minuten erhöht [Turton 1996; Hellström 2004] Ein dauerhaft erhöhtes Sättigungssignal am Hypothalamus kann zu einer Gewöhnung des Gehirns an diese erhöhten Spiegel führen. Dadurch kommt es nicht nur zu einer allmählichen Verminderung der Gewicht-reduzierenden Wirkung, sondern bei Absetzen der Therapie kann die Wirkung sogar in das komplette Gegenteil umschlagen. Das Gehirn versucht dann (z.B. durch Heißhunger-Attacken), die "gewohnten" GLP-1-Spiegel wieder selbst herzustellen und aus der Praxis ist bekannt, dass Patienten nach Beendigung einer Gewichtsabnahme mit langwirksamen GLP-1-Analoga häufig sehr schnell wieder Gewicht zunehmen bzw. sogar gezwungen sind, die GLP-1-Therapie wieder aufzunehmen, um Ihr Gewicht zu halten. Durch den bevorzugten Einsatz der kurzwirkenden GLP-1-Analoga tritt der Gewöhnungseffekt deutlich seltener auf. In einer der wenigen prospektiven direkten Vergleichsstudien in der kurzwirksame und langwirksame GLP-1-Agonisten hinsichtlich der Gewichtsabnahme untersucht wurden (Liraglutid vs. OW-Exenatid, DURATION-6 Studie) war dann folgerichtig über einen Zeitraum von 6 Monaten Liraglutid (-3,6 kg) bei den Gewichtsverläufen dem OW-Exenatid (-2,7 kg) signifikant überlegen [Buse 2013, Crane 2016].
Zu den häufigen Nebenwirkungen der GLP-1-Agonisten gehören Übelkeit, Erbrechen und Durchfall, die jedoch meistens vorübergehend sind.
SGLT-2-Inhibitoren
SGLT-2 (Natrium-Glukose-Kotransporter 2) -Inhibitoren hemmen die Rückresorption von Glukose in den Nieren, was zu einer erhöhten Ausscheidung von Glukose im Urin führt [Abdul-Ghani 2008, Chen 2013]. Die Rückresorption erfolgt physiologischerweise bis zu einer Glukosekonzentration von ca. 180 mg/dL (Nierenschwelle). Bei höheren Blutzuckerwerten wird die Glukose zum Zellgift. Die Niere versucht die Spiegel durch Ausscheidung in den Urin zu reduzieren, was bekanntlich in Antike und Mittelalter zur Diagnosestellung verwendet wurde [Ahmed 2002]. Durch einen SGLT-2-Inhibitor wird die Nierenschwelle bis in den Normbereich gesenkt und man kann davon ausgehen, dass ca. 300-400 kcal pro Tag an Energie ausgeschieden wird. Dies kann bei einer geplanten Gewichtsabnahme bei Patienten unterstützend eingesetzt werden [Barnett, 2013]. Auch die Reduktion der hormonellen Aktivität des viszeralen Fettgewebes wird gefördert, wodurch im Körper auch weniger Angiotensin zur Verfügung steht [Ye 2009]. Dies und die Tatsache, dass mit der Glukose auch Natrium ausgeschieden wird und durch eine zusätzliche diuretische Wirkung, kann zu einer Senkung des Blutdrucks führen [Tikkanen 2015, Pfeifer 2017]. Neuere Studien haben gezeigt, dass SGLT-2-Inhibitoren auch das Risiko für kardiovaskuläre Ereignisse und die Verschlechterung der Nierenfunktion bei Patienten mit Typ-2-Diabetes reduzieren können [Wang 2019; Alexander 2022]. Mittlerweile sind SGLT-2-Inhibitoren auch für die Behandlung der Herzinsuffizienz zugelassen und haben rasch Einzug in die entsprechenden nationalen und internationalen Therapieleitlinien halten können [Heidenreich 2024]. Ich setze SGLT-2-Inhibitoren bei meinen personalisierten Therapien daher regelhaft als zusätzliche und verstärkende Komponente für die Gewichtsabnahme und Blutzuckersenkung und gerne in Kombination mit einem GLP-1-Agonisten oder Pioglitazon ein.
Die häufigsten Nebenwirkungen von SGLT-2-Inhibitoren sind Harnwegsinfektionen und Genitalinfektionen, da die erhöhte Glukose im Urin ein Nährboden für Bakterien und Pilze sein kann. Es ist auch wichtig zu beachten, dass diese Medikamente das Risiko für eine (seltene) euglykämische Ketoazidose erhöhen können [Pfützner 2017].
Insulin – ein ambivalentes Hormon
In den aktuellen Leitlinien wird Insulin als letzte therapeutische Option empfohlen, wenn die eskalierende Intervention beginnend mit Diät und Metformin auch bei zusätzlicher Gabe weiterer anti-diabetischer Medikamente nicht mehr zum Erfolg führt [ElSayed 2023). Durch diese Vorgehensweise wird ein massives therapeutisches Potential nicht genutzt, dass sowohl im Stoffwechsel wie auch bei der Vasoprotektion vorhanden ist [Forst 2009]. Schon mehrfach wurde in der Literatur gezeigt, dass eine frühzeitige temporäre Behandlung mit prandialem Insulin oder mit Basalinsulin über 2-3 Wochen eine länger andauernde glykämische Remission herbeiführen kann, bei der die Patienten in der Lage sind, eine Normoglykämie ohne antidiabetische Medikamente aufrechtzuerhalten [Kramer 2013]. Diese Therapie ist insbesondere im asiatischen Raum verbreitet und ist nach meiner Erfahrung vor allem beim ß-Zelldysfunktions-Phänotyp erfolgreich. Li et al. fanden jedenfalls heraus, dass eine temporäre intensivierte Insulintherapie zur Verbesserung der ß-Zellfunktion und insbesondere zur Wiederherstellung der frühen Insulinantwort auf eine Mahlzeit führen kann [Li 2004]. Ich setze daher gerne frühzeitig eine niedrig-dosierte basale Insulintherapie zur Unterstützung der ß-Zellen in Kombination mit anderen oralen Antidiabetika ein, um die Produktionskapazität der ß-Zellen zu erhalten oder sogar zu verbessern. Im Übrigen wurde bereits bei der gemeinsamen Konsenserklärung der amerikanischen (ADA) und europäischen (EASD) Fachgesellschaften eine anfängliche temporäre Insulintherapie als Option vorgeschlagen, wenn der HbA1c-Wert ≥9 % ist, und eine definitive Erwägung bei einem HbA1c-Wert von ≥10-12 % [Davies 2022]. Ziel dieser Intervention ist es, die anfängliche Glukotoxizität aufzuheben, und danach ggfs. wieder zu anderen nicht insulinbasierten Therapien zurückzukehren. Aufgrund der zunehmenden Evidenz hat eine Expertengruppe das Konzept der kurzfristigen intensiven Insulintherapie als Option für einige Patienten mit Typ-2-Diabetes zum Zeitpunkt der Diagnose befürwortet. Die israelischen Leitlinien empfehlen z.B. schon seit einigen Jahren eine sofortige, manchmal kurzfristige Insulinbehandlung für Patienten mit einem HbA1c-Wert von über 9 % oder mit Symptomen [Tsur 2005]. Es wurde berichtet, dass fast ein Viertel (23 %) der neu diagnostizierten Typ-2-Patienten in den USA vor Behandlungsbeginn einen HbA1c-Wert von ≥9,0 % hatten [IDF 2023].
Die physiologische Aktivierung der vaskulären endothelialen Insulinrezeptoren durch die richtige Insulindosis und mit der richtigen Kinetik führt dabei nicht zur Glukoseaufnahme ins Endothel, sondern zur Aktivierung der endothelialen Stickoxydsynthase (eNOS) und zur Produktion und Ausschüttung von Stickoxyd (NO). NO hat starke reduzierende Wirkungen und schützt die Endothelien z.B. vor dem oxidativen Stress, dem sie nach einer Mahlzeit durch das Blut ausgesetzt sind. Die unphysiologische Aktivierung des gleichen Rezeptors bei Insulinresistenz (falsche Dosis, falsche Kinetik) führt durch einen anderen Signaltransduktionsweg zur Aktivierung der mitogen-abhängigen Proteinkinase (MAP-Kinase) und zur Ausschüttung von Endothelin-I, einem proinflammatorischen Zytokin. Zusammengefasst kann man also sagen: wird Insulin erst spät im Verlauf der Diabeteserkrankung eingesetzt, senkt es zwar noch den Blutzucker, hat aber an den Gefässen eher eine atherogene Wirkung [Forst 2009]. Als Trigger für die Sensitivität der mikrovaskulären Insulinrezeptoren wird die physiologische Pulsatilität der Insulinsekretion angesehen. Die physiologische Insulinsekretion erfolgt mit einer niedrigen Frequenz von 6 Pulsen/h und nicht in einem kontinuierlichen Fluss und geht bei beiden Diabetesformen (Typ 1 und Typ 2) schon in sehr frühen Phasen der Erkrankung verloren [Hellmann 2009; Wahren 2012]. Dieses Phänomen könnte neben der Glukotoxizität bei unzureichender Behandlung dazu beitragen, dass bei beiden Diabetestypen regelhaft die gleichen mikrozirkulatorischen Spätschäden auftreten [ElSayed 2023].
Vom Phänotyp zur Therapie
Bei unserer personalisierten Diabetestherapie verwenden wir zielgerichtet die unterschiedlichen Auswirkungen der Interventionen auf die Grundstörungen der Erkrankung, um die Progression der Erkrankung zu verlangsamen oder sogar zu verhindern. Ich empfehle meinen Patienten aus pathophysiologischen Überlegungen heraus eine kohlenhydratarme und Protein-reiche Kost. Bei der medikamentösen Therapie setze ich gerne bereits frühzeitig sinnhafte Kombinationen ein. Diese Vorgehensweise ist bei dokumentierter Metforminunverträglichkeit sogar ganz im Sinne unserer aktuellen Diabetestherapie-Leitlinien [Landgraf 2023; BÄK 2021]. Alle zur Diabetestherapie zugelassenen Interventionen senken bekanntlich mehr oder weniger gut den Blutzucker (siehe Tabelle 1). Ein Überblick der bevorzugten Interventionen in Abhängigkeit vom Phänotyp basierend auf den durchaus unterschiedlichen Wirkungen der verschiedenen Diabetesmedikationen auf die Grundstörungen der Erkrankung ist in Abbildung 2 dargestellt.
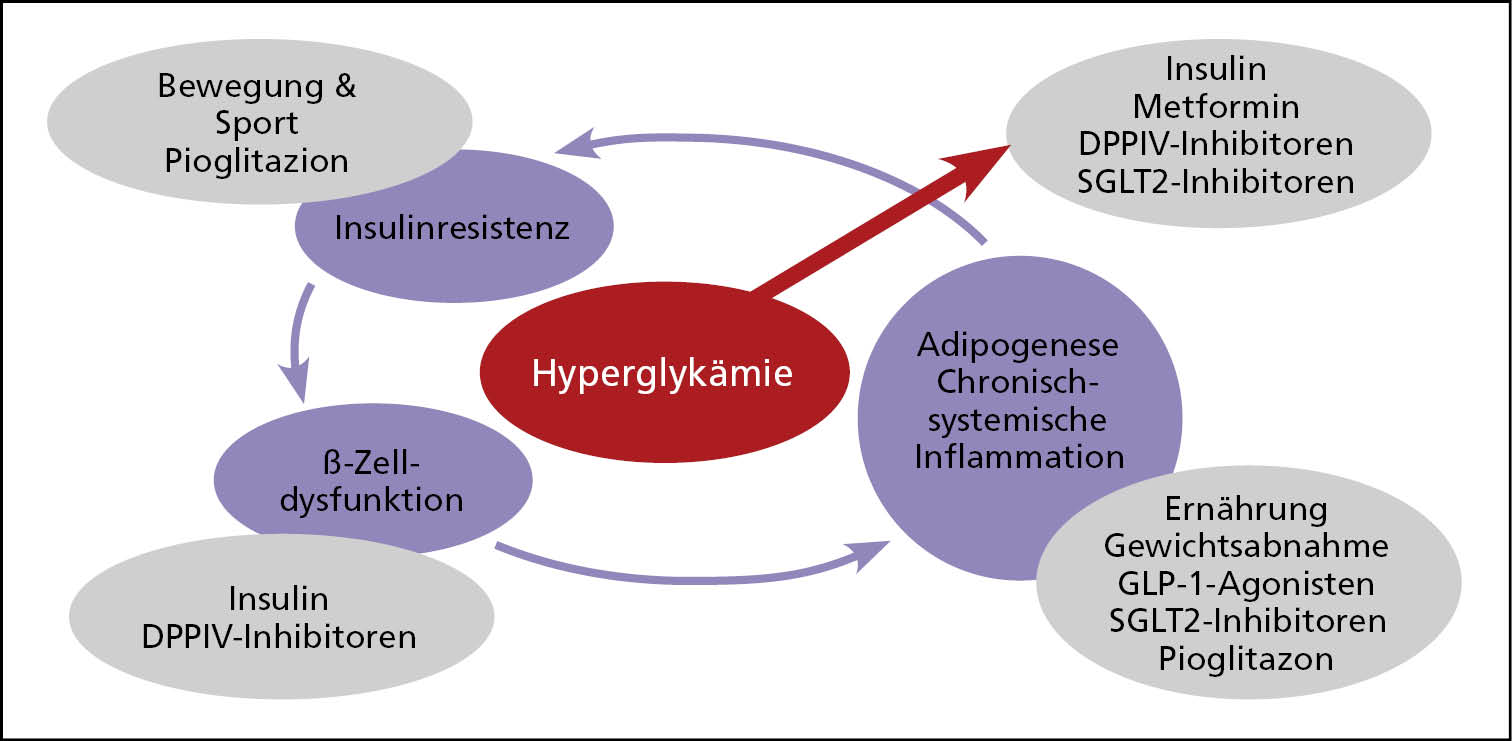 Abb. 2: Auswahl der Medikamente zur zielgerichteten Behandlung der unterschiedlichen Grundstörungen beim Typ-2-Diabetes.
Abb. 2: Auswahl der Medikamente zur zielgerichteten Behandlung der unterschiedlichen Grundstörungen beim Typ-2-Diabetes.
Fallbeispiele aus meiner Praxis
Gerne möchte ich abschließend die Vorgehensweise und ihre Ergebnisse anhand von zwei Fallbeispielen aus meiner Praxis verdeutlichen:
Patient AP (männlich, Alter: 69 Jahre bei Erstvorstellung am 15.07.2015. Diabetesdauer 5 Jahre, Größe: 176 cm, Gewicht 103,2 kg, BMI: 33,2 kg/m²). HbA1c: 7,5 % (Normwert: < 6,5 %) unter Monotherapie mit Dapagliflozin (10 mg) bei Metforminunverträglichkeit. Initiale Werte der Phänotypisierungsparameter: intakt Proinsulin: 10,5 pmol/L (Normwert: < 7 pmol/L); Adiponektin: 4,1 mg/L (Normwert bei Männern: > 6 mg/L), hsCRP: 2,71 mg/L (Normwert < 1 mg/L). Diese Laborkonstellation beschreibt einen unbefriedigend eingestellten Diabetes mit ß-Zelldysfunktion im Stadium III (Pfützner 2004), substantieller Insulinresistenz und moderat erhöhtem kardiovaskulärem Risiko. Die Therapie wurde daher durch die zusätzliche Gabe von 45 mg Pioglitazon ergänzt. Hierunter normalisierten sich alle Parameter dauerhaft (siehe Abb. 3). Da es in den Folgejahren zweimal zu Harnwegsinfektionen kam (unter Dapagliflozin Ende 2015; bei einem Umstellungsversuch auf Empagliflozin 2019), wurden die SGLT2-Inhibitoren dauerhaft durch den DPP-IV-Inhibitor Saxagliptin (5 mg) ersetzt.
 Abb. 3.: Patient AP, 69 Jahre, Verlauf von HbA1c und Phänotypisierungs-parametern in den Jahren 2015 – 2023 unter der optimierten SOC+ Kombinationstherapie (Pioglitazon 45 mg/Saxagliptin 5 mg).
Abb. 3.: Patient AP, 69 Jahre, Verlauf von HbA1c und Phänotypisierungs-parametern in den Jahren 2015 – 2023 unter der optimierten SOC+ Kombinationstherapie (Pioglitazon 45 mg/Saxagliptin 5 mg).
Unter dieser Therapie zeigen sich bis heute (Ende 2023) keine Hinweise für eine weitere Progression der Erkrankung, und dies obwohl es dem Patienten bisher nicht gelungen ist, dauerhaft Gewicht abzunehmen. Das Gewicht war bis auf einen gezielten, aber nicht nachhaltigen Abnahmeversuch 2017 (bei 103,5 kg) stabil bei 99-103 kg, aktuell im November 2023: 99,8 kg).
Patientin VLT (weiblich, 62 Jahre, Neumanifestation, Größe: 175 cm, Gewicht: 94 kg, BMI: 30,7 kg/m², HbA1c: 10,2 %). Die initiale Therapie durch den Hausarzt bestand zuerst aus Metformin 500 mg (1-0-0), das zu gastrointestinalen Nebenwirkungen führte, und anschließend aus Glimiperid 3 mg. Die Werte der Phänotypisierungsparameter bei der Erstvorstellung im August 2012 zeigten eine deutliche Erhöhung von intakt Proinsulin (14,5 pmol/L; Normwert: < 7 pmol/L); eine Adiponektinsuppression (2,1 mg/L; Normwert bei Frauen: > 8 mg/L), und ein hsCRP-Wert im Hochrisikobereich (6,4 mg/L; Normwert < 1 mg/L). Es handelte sich daher um einen Phänotyp, der vor allem durch die Insulinresistenz und eine chronisch-systemische Inflammation getrieben ist, was eine qualitativ erhöhte, aber fehlerhafte Sekretion der ß-Zellen zur Folge hatte. Bei der Therapie standen für mich daher die Reduktion der hormonellen Aktivität des viszeralen Fettgewebes durch Gewichtsabnahme, eine Verbesserung der ß-Zellfunktion und eine Reduktion der chronisch systemischen Inflammation im Vordergrund. Die Patientin wurde von mir initial wie folgt therapiert: Liraglutid 0,6 mg 1-0-0, Pioglitazon 30 mg 1-0-0, Sitagliptin 50 mg 1-0-0. Die Liraglutiddosis wurde nach 2 Wochen auf 1,2 mg gesteigert.
Unter dieser optimierten SOC+ Kombinationstherapie hat die Patientin seit über 11 Jahren eine stabile Diabeteseinstellung und keinen Hinweis für eine Diabetesprogression. In den ersten 6 Monaten nahm sie 5 kg ab (auf 89 kg/29,7 kg/m²); ein Effekt, der auch in den Folgejahren mit geringen Schwankungen kontinuierlich anhielt (aktuell im Oktober 2023: 72 kg/23,5 kg/m²). Im Herbst 2020 erkrankte die Patientin an einer SARS-CoV-2 Infektion mit schweren Grippesymptomen; ansonsten gab es keine gesundheitliche Probleme.
Die von mir vorgestellten Patientenfälle stehen beispielhaft für die Behandlungsergebnisse, die ich mit meiner Vorgehensweise regelhaft erziele. Die Therapie kann nach der initialen Auswahl und ggfs. zeitnahen Adaptation aufgrund von Nebenwirkungen oder Unverträglichkeiten in der Regel über die weitere Therapiedauer konstant gehalten werden, sofern es nicht zu weiteren Erkrankungen oder Komplikationen (wie z.B. substantielle Gewichtszunahme) kommt. Im Fall einer akuten Insulinresistenzentwicklung (z.B. persönlicher Stress, Operationen, schwere Erkrankungen) empfehle ich gelegentlich den Patienten eine temporäre Insulintherapie, bis die Ursache der Insulinresistenz wieder beseitigt worden ist.
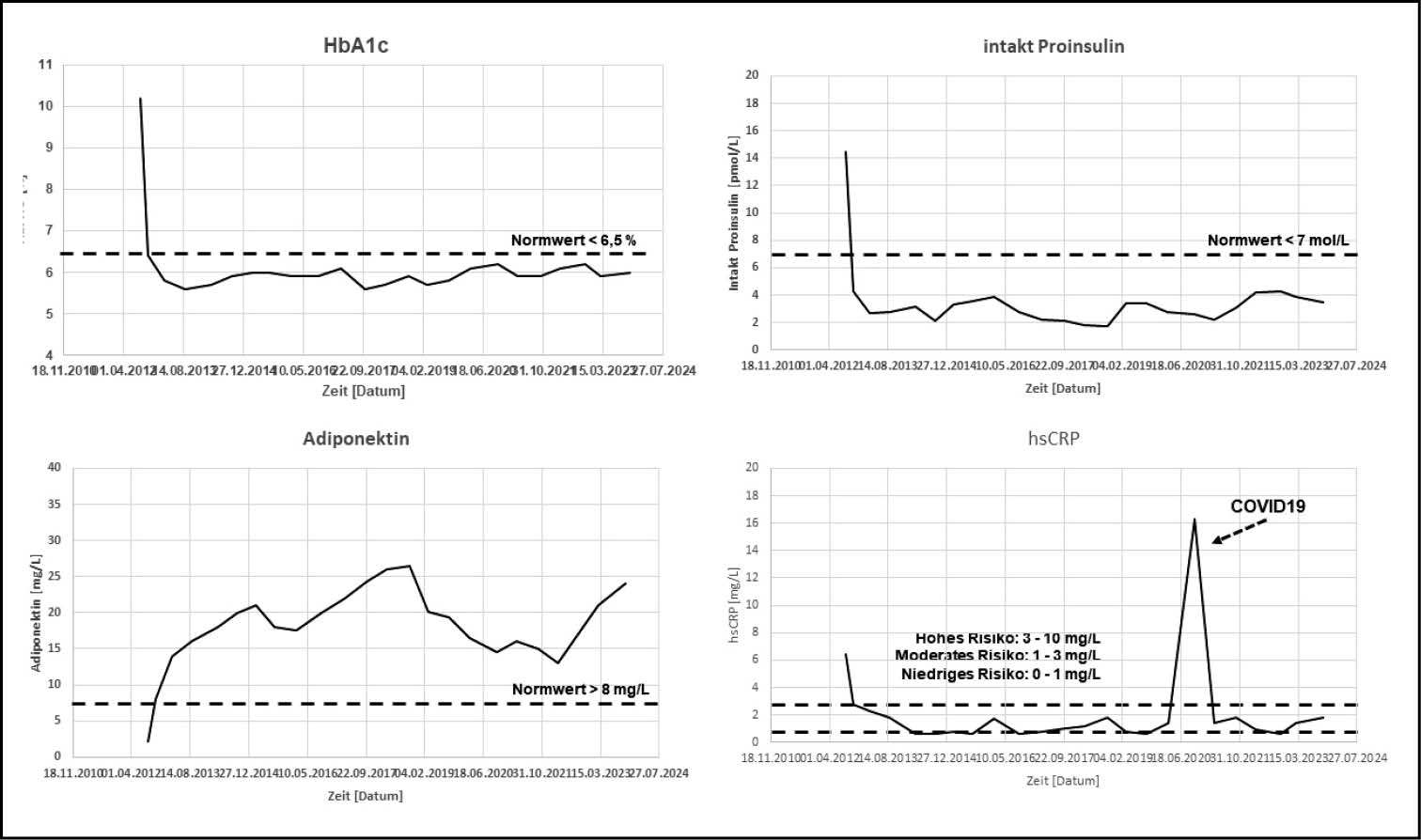 Abb. 4.: Patient VLT, 62 Jahre, Verlauf von HbA1c und Phänotypisierungsparametern in den Jahren 2012 – 2023 unter der optimierten SOC+ Kombinationstherapie (Liraglutid 1,2 mg, Pioglitazon 30 mg, Sitagliptin 50 mg).
Abb. 4.: Patient VLT, 62 Jahre, Verlauf von HbA1c und Phänotypisierungsparametern in den Jahren 2012 – 2023 unter der optimierten SOC+ Kombinationstherapie (Liraglutid 1,2 mg, Pioglitazon 30 mg, Sitagliptin 50 mg).
Schlussfolgerungen und -betrachtungen
In meiner Praxis versuchen wir durch zusätzliche Bestimmung von Biomarkern und durch konsekutive Phänotypisierung mit nachfolgender individualisierter Diabetestherapie die Progression der Diabeteserkrankung und damit auch die Entwicklung von Spätschäden zu verhindern. Dies gelingt durch die von mir in Teil 1 und Teil 2 dieses Diskussionspapiers beschriebene Vorgehensweise fast in allen Fällen. Bei guter Restsekretion kann auch der Versuch unternommen werden, durch eine temporäre individualisierte polypharmazeutische De-Eskalationstherapie eine Remission der Diabeteserkrankung zu erreichen. Ich habe hierzu bereits einige erfolgreiche Kasuistiken bei Verkehrspiloten publiziert (Pfützner 2019).
Ich hoffe, ich konnte mit diesem Diskussionsbeitrag und mit der Darstellung der von mir seit Jahren erfolgreich praktizierten funktionellen Phänotypisierung und konsekutiven individuellen Auswahl einer personalisierten Behandlung interessierten Kollegen einen alternativen Weg für eine pathophysiologisch-orientierte Typ-2-Diabetestherapie vorstellen. Der Blutzucker und der HbA1c stehen dabei als Symptome nicht mehr im Vordergrund – sie verbessern sich bei meiner Vorgehensweise ohnehin – sondern vielmehr die Grundstörungen des Krankheitsbilds. Nach meiner Erfahrung lässt sich mit dieser Vorgehensweise eine Progression des Typ-2-Diabetes zumindest verhindern.
Es wird sicherlich zu meinen Lebzeiten keine randomisierte kontrollierte und prospektive klinische Studie mehr geben, um die mögliche Überlegenheit meines Konzepts über die glukozentrische Standardtherapie zu belegen. Hierzu fehlt zum einen das Interesse der Pharmaindustrie, dem Hauptgeldgeber für die klinische Forschung, da ich etablierte Medikamente verwende und über den gesamten Therapiezeitraum durch die fehlende Progression schließlich auch deutlich weniger Pharmaka benötige. Die Vorstellung meines Konzeptes bei Entscheidungsträgern in der Politik, bei den Krankenkassen, aber auch bei Patientenvertretern hat in der Vergangenheit andererseits auch kein ausreichendes Interesse wecken können, am bestehenden System etwas zu verändern. Viele meiner akademischen diabetologischen Kollegen nehmen das Konzept durchaus wohlwollend zur Kenntnis, sehen aber auch keinen akuten Handlungsbedarf, für sich oder ihre Patienten etwas an der glukozentrischen Vorgehensweise zu verändern. Interessant ist in diesem Zusammenhang, dass sich in meinem Patientenkollektiv und insbesondere im Nachgang zu den von mir geführten Gesprächen und Vorträgen mittlerweile Vertreter aller dieser Gruppen finden lassen. Ich habe den Weg der Vorstellung meines Konzeptes als Diskussionspapier gewählt, um interessierte und aufgeschlossene Kollegen zu erreichen und dazu einzuladen, es ggfs. einfach mal selbst auszuprobieren. Meine Vision ist, dass hierdurch mehr betroffenen Menschen mit Diabetes ein längeres Leben und dabei ein Altern in Würde und möglichst ohne Spätschäden ermöglicht werden kann.
Literatur beim Verfasser
|
|
Erschienen in: Diabetes-Forum, 2024; 36 (4) Seite 20-28


