Zwischen den drei genannten Erkrankungen gibt es eine Verknüpfung. Die Entwicklung einer Demenz wird sowohl von Diabetes als auch von Schlaganfall stark begünstigt. Professor Joachim Röther und Professorin Waltraud Pfeilschifter leiten unseren Schwerpunkt mit diesen Themen ein.
Der Diabetes mellitus ist eine Zivilisationskrankheit, die weltweit rasch zunimmt. Laut American Diabetes Association (ADA) lag der Anteil von Menschen mit Diabetes oder blutzuckersenkender Medikation im Jahr 2022 bundesweit bei 5 % (11,3 % in den USA; https://diabetes.org/about-diabetes). Ab 65 Jahren wiesen 12 % der deutschen Bevölkerung einen Diabetes auf (25 % in den USA), wobei Männer in dieser Altersgruppe häufiger von Diabetes betroffen sind als Frauen (16 % vs. 9 %; https://www.bfs.admin.ch/bfs/de/home/statistiken/gesundheit/gesundheitszustand/krankheiten/diabetes.html).
Die überwiegende Mehrheit der Diabeteserkrankungen betrifft den Typ-2-Diabetes aufgrund von Insulinresistenz, dessen Auftreten durch ungesunde Ernährung und fehlende körperliche Aktivität begünstigt wird. Epidemiologische Daten aus Deutschland weisen darauf hin, dass es hierzulande mindestens 8,9 Mio. dokumentierte Fälle von Typ-2-Diabetes und eine Dunkelziffer von etwa 2 Mio. Erkrankten gibt (1). Die direkten Kosten aufgrund von Diabetes werden für das Jahr 2020 insgesamt auf 7,4 Mrd. Euro geschätzt (Frauen: 3,4 Mrd.Euro; Männer: 4,0 Mrd. Euro (https://diabsurv.rki.de/Webs/Diabsurv/DE/diabetes-in-deutschland/4-33_Direkte_Krankheitskosten.html#:~:text=Die%20direkten%20Kosten%20f%C3%BCr%20Personen,M%C3%A4nner%3A%202%2C1%20%25)).
Nachfolgend wird die Koinzidenz von Schlaganfall und Demenz bei Diabetes mellitus (DM) Typ 2 betrachtet.
Zunahme juveniler Schlaganfälle bei Diabetes
Diabetes begünstigt Ablagerungen an den Gefäßwänden (Atherosklerose) und erhöht daher das Risiko von Gefäßerkrankungen: Neben Hirn- und Herzinfarkten (Makroangiopathie) sind das die diabetische Retinopathie, Neuropathie sowie Nierenerkrankung (Nephropathie) und auch Schädigungen der kleinen Hirnkapillaren (Mikroangiopathie). Bereits bei relativ jungen Schlaganfallpatienten in der Altersgruppe von 40 bis 55 Jahren sind Makro- und Mikroangiopathie häufige Ursachen eines Schlaganfalls, und es ist davon auszugehen, dass die steigende Diabeteshäufigkeit hierzu beiträgt (Abb. 1). Im Hinblick auf mögliche Schlaganfallursachen nehmen durch Diabetes sowohl die Makroangiopathie (Karotisstenose, intrakranielle Stenosen), kardioembolische Schlaganfälle bei Vorhofflimmern als auch die zerebrale Mikroangiopathie zu.
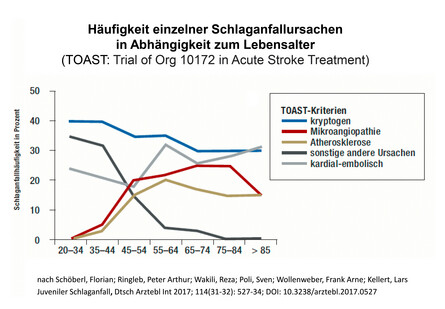
Hohes Risiko für Demenz
Demenzerkrankungen sind aufgrund der steigenden Lebenserwartung weltweit auf dem Vormarsch. Die Prävalenz liegt in den meisten Ländern bei 5 bis 7 %. In Deutschland betrug die Zahl der Menschen mit Demenz im Jahr 2021 etwa 1,8 Millionen. Im gleichen Jahr waren ca. 360 000 bis 440 000 Menschen neu an Demenz erkrankt (Deutsches Ärzteblatt: Archiv "Demenz in Deutschland: Epidemiologie und Präventionspotential"; 10.07.2023).
Epidemiologische Langzeituntersuchungen belegen, dass Diabetes nicht nur ein Risikofaktor für den Schlaganfall, sondern auch für die Entwicklung kognitiver Leistungsdefizite ist. Eine Metaanalyse fand bei Diabetespatienten ein um 73 % erhöhtes Risiko für die Entwicklung einer Demenz, wobei die vaskuläre Demenz (127 % Risikozunahme) häufiger diagnostiziert wurde als die Alzheimer Demenz (56 % Risikozunahme) (2). Dabei lassen sich sowohl schlechtere kognitive Leistungen im Vergleich zu Kontrollpersonen als auch eine raschere Abnahme dieser kognitiven Funktionen über die Zeit ("cognitive decline") feststellen.
Die Ursachen der erhöhten Prävalenz von Demenz bei Diabetes sind multifaktoriell: Vaskulär-ischämische Schäden, negative Einflüsse von Hyper- und Hypoglykämien, der Einfluss von Inflammation, eine gestörte Blut-Hirn-Schranke, der verminderte Abtransport toxischer Stoffwechselprodukte über das glymphatische System und komplexe Störungen im Rahmen der Insulinresistenz werden diskutiert (3,4).
Hypo- und Hyperglykämie
Veränderungen der grauen Hirnsubstanz und Schädigung des Hippocampus
Die Hypoglykämie ist eine häufige Komplikation der Diabetestherapie. Eine Hypoglykämie liegt vor, wenn der Plasma-Glukosespiegel weniger als 70 mg/dl (3,8 mmol/l) aufweist. Die Prävalenz von Hypoglykämien beträgt bei DM Typ 2 etwa 10 %. Die Manifestationen der Hypoglykämie sind variabel und reichen von einer Stressreaktion über epileptische Anfälle und Enzephalopathien bis hin zum Koma. Die Wahrnehmung der Vorboten einer Hypoglykämie nimmt bei älteren Patienten ab. Pathophysiologische Mechanismen, die im Zusammenhang von Hypoglykämien und Demenz bei Diabetikern diskutiert werden, sind strukturelle Veränderungen der grauen Hirnsubstanz mit kortikaler Atrophie und eine Schädigung des Hippocampus.
Akkumulation von AGEs und Formation von Alzheimerplaques
Aber auch Hyperglykämien und überhaupt die Güte der Blutzuckereinstellung haben einen Einfluss auf die Kognition. So zeigte die ACCORD-MIND-Studie, dass eine Zunahme des HbA1c um 1 % mit einer Verschlechterung des Minimental-Status-Tests um 0,14 Punkte assoziiert ist (5). Die chronische Hyperglykämie führt zu einer Akkumulation von AGEs (advanced glycation endproducts). AGEs führen zur Produktion von ROS (reactive oxygen species) und proinflammatorischen Zytokinen, welche die kleinen Gefäße schädigen. Außerdem führen AGEs zu einer vermehrten Ablagerung von Amyloid beta und fördern die Formation von Alzheimerplaques. Ein erhöhter HbA1c -Wert korreliert zudem mit einem niedrigeren Hirnvolumen im Vergleich zur nicht-diabetischen Kohorte (6). Auch im Gehirn wurde ein gewisses Maß an Insulinproduktion festgestellt und Zellen des Gehirns, insbesondere Neuronen im Bereich des Hippocampus und der grauen Hirnsubstanz weisen Insulinrezeptoren auf. Insulin scheint eine Rolle in der Gedächtniskonsolidierung zu spielen. Neben der Insulinresistenz peripherer Gewebe gibt es vermutlich auch eine Insulinresistenz des Gehirns (7).
Zusammenhang zwischen Ausmaß zerebraler Mikroangiopathie, Alter und Demenz
Verschiedene Faktoren fördern das Auftreten des Diabetes mellitus bei älteren Patienten: Die Insulinresistenz steigt mit dem Alter an, die Glukosetoleranz nimmt ab und die Insulinsekretion aus dem Pankreas sinkt.
Es wurde auch spekuliert, dass neben der vaskulären Demenz und der Alzheimer Demenz eine spezifische Demenz-Subgruppe bei Patienten mit Diabetes besteht. Diese Diabetes-assoziierte Demenz wurde definiert durch Abwesenheit einer parietotemporalen Hypoperfusion in der SPECT-Untersuchung, durch hohes Alter und hohen HbA1c-Wert, lange Krankheitsdauer, häufig mit Insulintherapie und fehlendem Nachweis einer Amyloid-Akkumulation im 11C-Pittsburgh compound-B PET (8). Allerdings bestehen Zweifel, ob eine solch komplexe Definition einer Diabetes-assoziierten Demenz existiert und eine praktische Rolle spielt.
Zweifellos besteht ein enger Zusammenhang zwischen dem Ausmaß der zerebralen Mikroangiopathie (CVD; cerebral small vessel disease), dem Alter und der Demenz. So findet man bei Diabetespatienten im zerebralen MRT häufiger stumme embolische sowie mikroangiopathische Hirninfarkte und eine ausgedehnte zerebrale Mikroangiopathie.
Adipositas: Expression inflammatorischer Zytokine und dreifach höheres Demenzrisiko
Bei Adipositas verursachen chronisch erhöhte Fettsäurespiegel eine Lipidakkumulation in Adipozyten. Das resultierende Übermaß an Körperfett fördert die Entwicklung eines DM Typ 2. Die Zunahme der Prävalenz von Adipositas geht mit der Zunahme von Typ-2-Diabetes einher. Die zellulären und physiologischen Mechanismen dieser Assoziation sind komplex, jedoch spielt eine Adipositas-induzierte Änderung der Betazellfunktion im Pankreas und eine Insulinresistenz eine wichtige Rolle. Die Insulinresistenz führt zum metabolischen Syndrom und eine erhöhte Expression inflammatorischer Zytokine fördert die Pathogenese einer Alzheimererkrankung. Das Risiko eine Demenz zu entwickeln ist daher bei adipösen Patienten um das Dreifache erhöht (9).
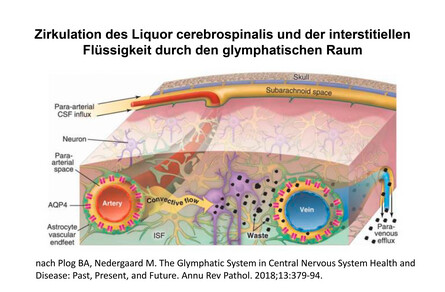
Dysfunktion von Liquor-Strom und interstitieller Flüssigkeit bei Diabetes
Interessant ist die mögliche Rolle des zerebralen glymphatischen Systems (10). Das zerebrale glymphatische System ist wichtig, um Toxine und Abbauprodukte zusammen mit dem Liquor aus dem Gehirn abzuleiten und die Homöostase aufrecht zu erhalten. Hierzu ist ein dreistufiger Prozess erforderlich, der mit der Zirkulation des Liquors von den basalen Zisternen in den Subarachnoidalraum der Großhirnhemisphären beginnt; der Liquor tritt dann in den periarteriellen Raum über, wo membranständige Wasserkanäle (Aquaporin; AQP4) in den Enden der Astrogliazellen die interstitielle Flüssigkeit zusammen mit Abbauprodukten über das perivenöse Kompartment in die Ventrikel abtransportiert. Eine Dysfunktion dieses kontinuierlichen Stroms von Liquor und interstitieller Flüssigkeit wird bei Diabetespatienten u.a. durch eine verringerte zerebrovaskuläre Pulsatilität und eine niedrigere Expression der Aquaporin-Kanäle bedingt. Die Folge ist eine 40 %-ige Verringerung des Abtransports von Amyloid beta und hierdurch bedingter kognitiver Beeinträchtigung (11).
Therapeutische Optionen zur Demenz-Verhinderung bei Diabetes
Letztlich ist davon auszugehen, dass alle Maßnahmen, die die diabetische Stoffwechsellage positiv beeinflussen, mit einer Reduktion des Demenzrisikos aber auch von Schlaganfällen und anderen vaskulären Gefäßkomplikationen einhergehen. Eine umfassende Darstellung der Therapieoptionen findet sich in der Nationalen Versorgungs-Leitlinie (NVL) Typ-2-Diabetes-Version 3 (Typ-2-Diabetes-Leitlinien.de).
Das Vermeiden von Hypo- und Hyperglykämien, die zielwertgerechte Einstellung des HbA1c, eine Reduktion des LDL-Werts in Abhängigkeit zum Risikoprofil, eine optimale medikamentöse Behandlung mittels Antihypertensiva, Antidiabetika und gegebenenfalls Insulin sowie den Lebensstil modifizierende Maßnahmen sind die Kernpunkte.
Interessant ist ein potentieller Einfluss von SGLT-2-Inhibitoren (13) und GLP-1-Rezeptoragonisten (14) auf das Demenzrisiko bei Diabetespatienten. Dieser Effekt scheint plausibel, da jede Verbesserung der diabetischen Stoffwechsellage die komplexen Zusammenhänge von Demenz bei Diabetes beeinflussen sollte. Das Präventionspotential der Demenz erfasst neben den klassischen vaskulären Risikofaktoren auch potentiell modifizierbare Risikofaktoren wie niedriger Bildungsstand, Hörminderung, übermäßiger Alkoholkonsum, Adipositas, Rauchen, Depression, soziale Isolation, körperliche Inaktivität und Luftverschmutzung. Je mehr dieser Faktoren zusammenkommen, desto größer ist das Risiko für Demenz (Deutsches Ärzteblatt: Archiv "Demenz in Deutschland: Epidemiologie und Präventionspotential"; 10.07.2023). Viel Nachholbedarf besteht vor diesem Hintergrund auch bei einer frühzeitigen Gesundheitsaufklärung in Kindergärten und Schulen, dem gesunden Schulessen, der Intensivierung von Schulsport und Teilnahme an außerschulischen Sportaktivitäten, gefördert durch eine kostenfreie Mitgliedschaft in Sportvereinen.
|
|
|
|
Erschienen in: Diabetes-Forum, 2024; 36 (6) Seite 10-14



